题目内容
 (2012?海淀区一模)NaCl 和KNO3在不同温度时的溶解度如下,回答下列问题.
(2012?海淀区一模)NaCl 和KNO3在不同温度时的溶解度如下,回答下列问题. | 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
20.9
20.9
g KNO3时,溶液恰好达到饱和状态.(2)如图为NaCl 和KNO3的溶解度曲线,则表示NaCl的溶解度曲线是
乙
乙
(填“甲”或“乙”);其中温度t的范围可能在B
B
(填字母序号).A.10℃~20℃B.20℃~30℃C.30℃~40℃D.40℃~50℃
(3)10℃时,分别在100g 水中加入35g NaCl 和KNO3固体,加热到60℃时,NaCl溶液为
不饱和
不饱和
(填“饱和”或“不饱和”)溶液.加热前后,有关两溶液的说法正确的是BC
BC
(填字母序号).A.10℃时,两溶液中溶质的质量分数相同
B.60℃时,两溶液中溶质的质量分数相同
C.加热前后,NaCl溶液中溶质的质量分数不变
D.加热前后,KNO3溶液中溶质的质量分数不变.
分析:(1)依据10℃时硝酸钾的溶解度解决.
(2)根据表中两物质的溶解度随温度变化的情况分析解决;
(3)依据加热前后两物质的溶解度变化情况,结合溶液中状态的改变对相关选项进行分析判断即可;
(2)根据表中两物质的溶解度随温度变化的情况分析解决;
(3)依据加热前后两物质的溶解度变化情况,结合溶液中状态的改变对相关选项进行分析判断即可;
解答:解:(1)由于10℃时硝酸钾的溶解度是20.9g,所以此温度下100g水中溶解20.9g硝酸钾溶液恰好达到饱和;
(2)从表中数据可以看出氯化钠的溶解度随温度改变大小变化不明显,而硝酸钾变化很明显,所以表示NaCl的溶解度曲线是乙图象,t℃时恰好是两曲线的交点,所以两者在该温度下溶解度相同,分析表中数据20℃~30℃的温度范围适合;
(3)10℃时,分别在100g 水中加入35g NaCl 和KNO3固体时氯化钠能完全溶解,此时氯化钠是不饱和溶液,硝酸钾不能完全溶解是饱和溶液,加热到60℃时氯化钠仍为不饱和溶液,而硝酸钾剩余固体全部溶解且溶液变成不饱和溶液,所以60℃时,两溶液中溶质的质量相同,因溶剂相同故溶质质量分数相同,对于氯化钠溶液来说加热前后,NaCl溶液中溶质与溶剂的两均未变化,故溶质的质量分数不变;
故答案为:(1)20.9(2)乙;B(3)不饱和;BC
(2)从表中数据可以看出氯化钠的溶解度随温度改变大小变化不明显,而硝酸钾变化很明显,所以表示NaCl的溶解度曲线是乙图象,t℃时恰好是两曲线的交点,所以两者在该温度下溶解度相同,分析表中数据20℃~30℃的温度范围适合;
(3)10℃时,分别在100g 水中加入35g NaCl 和KNO3固体时氯化钠能完全溶解,此时氯化钠是不饱和溶液,硝酸钾不能完全溶解是饱和溶液,加热到60℃时氯化钠仍为不饱和溶液,而硝酸钾剩余固体全部溶解且溶液变成不饱和溶液,所以60℃时,两溶液中溶质的质量相同,因溶剂相同故溶质质量分数相同,对于氯化钠溶液来说加热前后,NaCl溶液中溶质与溶剂的两均未变化,故溶质的质量分数不变;
故答案为:(1)20.9(2)乙;B(3)不饱和;BC
点评:溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线中看出的①同一溶质在不同温度下的溶解度;②同一温度下,不同溶质的溶解度;③温度对不同物质的溶解度影响不同等都是解决此类题的关键.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目

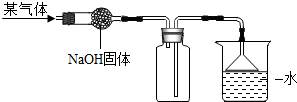 (2012?海淀区一模)如图是收集某气体的装置.由实验装置推测该气体的有关性质可能正确的是( )
(2012?海淀区一模)如图是收集某气体的装置.由实验装置推测该气体的有关性质可能正确的是( ) 
