题目内容
研究盐类物质的性质时,甲、乙、丙三位同学分别向NaHCO3溶液中滴加石灰水,均产生白色沉淀.他们分别设计实验方案,对自己过滤后的滤液中溶质的成分进行如下探究.
【实验准备】
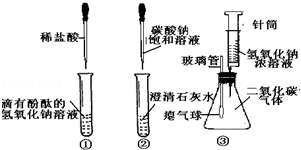
用一定溶质的质量分数的NaHCO3溶液、NaOH溶液和Na2CO3溶液进行如下实验,为设计实验方案提供参考.
表中的现象Ⅰ为 ;现象Ⅱ为产生蓝色沉淀,对应反应的化学方程式是 .
【查阅资料】
(1)氯化钙溶液显中性.
(2)滤液中所含的溶质有以下几种可能:①NaOH;②Na2CO3;③NaOH和Ca(OH)2;④Na2CO3和NaHCO3;⑤Na2CO3和NaOH
【实验及分析】
甲同学:取少量滤液于试管中,滴加过量的稀盐酸,产生大量无色气泡,则滤液中的溶质是Na2CO3.
乙同学:取少量滤液于试管中,向其中通入少量CO2,产生白色沉淀,则滤液中的溶质是
NaOH和Ca(OH)2.
丙同学:分别取少量滤液于两支试管中,向一支试管中滴加CaCl2溶液,有白色沉淀产生;将另一支试管中的滤液加热至沸腾,将产生的气体通入澄清石灰水,澄清石灰水变浑浊,则滤液中的溶质是Na2CO3和NaHCO3.
【反思与评价】
(1)老师认为乙、丙同学的实验方案和结论合理.
①丙同学的实验中,加入CaCl2溶液的目的是 .
②根据乙同学的结论,NaHCO3溶液与澄清石灰水反应的化学方程式是 .
(2)老师认为甲同学的实验方案和结论存在不足.丁同学通过以下实验帮助甲同学确认了滤液中溶质的成分.
(3)结合此次探究活动,你认为下列说法正确的是 (填字母序号).
a.盐溶液可能显碱性
b.化学反应的产物与反应物的量有关
c.碱和盐反应一定生成另外一种碱和另外一种盐
d.判断溶液混合后的成分不仅要考虑产物,还要考虑反应物是否过量.
【实验准备】
用一定溶质的质量分数的NaHCO3溶液、NaOH溶液和Na2CO3溶液进行如下实验,为设计实验方案提供参考.
| | NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 |
| 加入酚酞溶液 | 溶液变红 | 现象Ⅰ | 溶液变红 |
| 加入CuSO4溶液 | 产生气泡和蓝色沉淀 | 现象Ⅱ | 产生气泡和蓝色沉淀 |
| 加入CaCl2溶液 | 无明显变化 | 无明显变化 | 产生白色沉淀 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 | 澄清石灰水 无明显变化 |
【查阅资料】
(1)氯化钙溶液显中性.
(2)滤液中所含的溶质有以下几种可能:①NaOH;②Na2CO3;③NaOH和Ca(OH)2;④Na2CO3和NaHCO3;⑤Na2CO3和NaOH
【实验及分析】
甲同学:取少量滤液于试管中,滴加过量的稀盐酸,产生大量无色气泡,则滤液中的溶质是Na2CO3.
乙同学:取少量滤液于试管中,向其中通入少量CO2,产生白色沉淀,则滤液中的溶质是
NaOH和Ca(OH)2.
丙同学:分别取少量滤液于两支试管中,向一支试管中滴加CaCl2溶液,有白色沉淀产生;将另一支试管中的滤液加热至沸腾,将产生的气体通入澄清石灰水,澄清石灰水变浑浊,则滤液中的溶质是Na2CO3和NaHCO3.
【反思与评价】
(1)老师认为乙、丙同学的实验方案和结论合理.
①丙同学的实验中,加入CaCl2溶液的目的是 .
②根据乙同学的结论,NaHCO3溶液与澄清石灰水反应的化学方程式是 .
(2)老师认为甲同学的实验方案和结论存在不足.丁同学通过以下实验帮助甲同学确认了滤液中溶质的成分.
| 实验操作 | 实验现象 | 实验结论 |
| ① ② | ① ② | 滤液中的溶质是Na2CO3和NaOH |
(3)结合此次探究活动,你认为下列说法正确的是 (填字母序号).
a.盐溶液可能显碱性
b.化学反应的产物与反应物的量有关
c.碱和盐反应一定生成另外一种碱和另外一种盐
d.判断溶液混合后的成分不仅要考虑产物,还要考虑反应物是否过量.
【实验准备】溶液变红 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
【反思与评价】(1)①检验Na2CO3②NaHCO3+Ca(OH)2=NaOH+CaCO3↓+H2O
(2)
(3)abd
【反思与评价】(1)①检验Na2CO3②NaHCO3+Ca(OH)2=NaOH+CaCO3↓+H2O
(2)
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量滤液于试管中,加入过量CaCl2溶液 ②过滤,向滤液中滴加CuSO4溶液 | ①有白色沉淀生成 ②只产生蓝色沉淀,无气泡 | |
(3)abd
试题分析:【实验准备】氢氧化钠溶液呈碱性,使酚酞试液变红,氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,化学方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4【反思与评价】①丙同学:根据氢氧化钠、碳酸钠、碳酸氢钠、氢氧化钠的性质,能与氯化钙反应产生白色沉淀的只有碳酸钠,因此分别取少量滤液于两支试管中,向一支试管中滴加CaCl2溶液,是检验是否存在碳酸钠;碳酸氢钠的滤液加热至沸腾,将产生的气体通入澄清石灰水,澄清石灰水变浑浊②根据乙同学的实验及结论:取少量滤液于试管中,向其中通入少量CO2,产生白色沉淀,则滤液中的溶质是NaOH和Ca(OH)2二氧化碳与氢氧化钠反应生成碳酸氢钠,碳酸氢钠与氢氧化钙反应生成碳酸钙白色沉淀,化学方程式为NaHCO3+Ca(OH)2=NaOH+CaCO3↓+H2O(2)甲同学:取少量滤液于试管中,滴加过量的稀盐酸,产生大量无色气泡,则滤液中的溶质是Na2CO3若滤液中含有氢氧化钠和碳酸钠两种物质也会出现此种现象,加入的盐酸先和氢氧化钠反应,然后再和碳酸钠反应产生气泡,因此要确定是否含氢氧化钠,需先把碳酸钠除去然后再检验氢氧化钠,除去碳酸钠添加试剂时不能影响氢氧化钠的存在,因此可取少量滤液于试管中,加入过量CaCl2溶液与碳酸钠反应产生白色沉淀,过滤,向滤液中滴加CuSO4溶液,只产生蓝色沉淀,无气泡,则说明滤液中的溶质是Na2CO3和NaOH(3)a.盐溶液可能显碱性,如碳酸钠溶液呈碱性,正确;b.化学反应的产物与反应物的量有关,正确,如二氧化碳与氢氧化钠反应,少量的二氧化碳与氢氧化钠反应生成碳酸氢钠,正确c.碱和盐反应不一定生成另外一种碱和另外一种盐,如NaHCO3+Ca(OH)2=NaOH+CaCO3↓+H2Od.判断溶液混合后的成分不仅要考虑产物,还要考虑反应物是否过量,正确;故选abd

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目