题目内容
20℃时,物质的溶解度在0.1克~1克范围内为微溶.已知CaS04的溶解度如下表所示| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 1 00 |
| 溶解度(克) | 0.1980 | 0.2036 | 0.2097 | 0.2047 | 0.1966 | 0.1669 |
A.将石灰石研成粉末状慢慢加入足量硫酸溶液中
B.将块状石灰石加到热的硫酸溶液中
C.将少量的块状石灰石加到过量的硫酸溶液中
D.将块状石灰石加到冷的硫酸溶液中
【答案】分析:A、根据将石灰石研成粉末状会增大与硫酸的接触面积进行解答;
B、根据块状石灰石会减小与硫酸的接触面积且温度越高硫酸钙的溶解度越小进行解答;
C、根据少量的块状石灰石加到过量的硫酸溶液中反应会较慢进行解答;
D、根据块状石灰石加到冷的硫酸溶液中不如粉末状碳酸钙与硫酸的接触面积大进行解答.
解答:解:A、将石灰石研成粉末状会增大与硫酸的接触面积,所以能持续较快产生C02气体,故A正确;
B、块状石灰石会减小与硫酸的接触面积且温度越高硫酸钙的溶解度越小,所以将块状石灰石加到热的硫酸溶液中不能持续较快产生C02气体,故B错误;
C、少量的块状石灰石加到过量的硫酸溶液中反应会较慢,不能持续较快产生C02气体,故C错误;
D、块状石灰石加到冷的硫酸溶液中不如粉末状碳酸钙与硫酸的接触面积大,所以不能持续较快产生C02气体,故D错误.
故选:A.
点评:此题考查影响化学反应速率的内因和外界因素,同时也考查了学生分析图表应用的能力.
B、根据块状石灰石会减小与硫酸的接触面积且温度越高硫酸钙的溶解度越小进行解答;
C、根据少量的块状石灰石加到过量的硫酸溶液中反应会较慢进行解答;
D、根据块状石灰石加到冷的硫酸溶液中不如粉末状碳酸钙与硫酸的接触面积大进行解答.
解答:解:A、将石灰石研成粉末状会增大与硫酸的接触面积,所以能持续较快产生C02气体,故A正确;
B、块状石灰石会减小与硫酸的接触面积且温度越高硫酸钙的溶解度越小,所以将块状石灰石加到热的硫酸溶液中不能持续较快产生C02气体,故B错误;
C、少量的块状石灰石加到过量的硫酸溶液中反应会较慢,不能持续较快产生C02气体,故C错误;
D、块状石灰石加到冷的硫酸溶液中不如粉末状碳酸钙与硫酸的接触面积大,所以不能持续较快产生C02气体,故D错误.
故选:A.
点评:此题考查影响化学反应速率的内因和外界因素,同时也考查了学生分析图表应用的能力.

练习册系列答案
相关题目
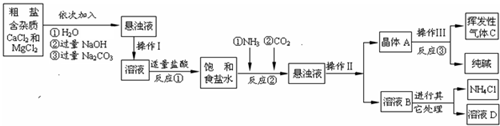
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
【产品与原理】
该厂采用“侯氏制碱法”生产化工产品--纯碱(Na2CO3)和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为:
NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl;分离出NaHCO3,加热制得纯碱.
【生产流程】
【相关资料】
(1)NH4Cl
NH3↑+HCl↑
(2)已知20℃时有关物质的溶解度如下
(气体指1体积水中能溶解的气体体积)
【问题讨论】:
(1)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为 .
(2)反应①中发生了两个反应,写出其中的一个化学方程式:
.
(3)反应③中得到纯碱的化学方程式为: .
(4)溶液B中的溶质有 (至少写出两种).
(5)上述生产流程中可循环使用的是 (填序号).
A.挥发性气体C; B.溶液D; C.氢氧化镁;D.化肥NH4Cl
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质 (写化学式).
【含量测定】
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,
请通过计算并结合右表判断此纯碱样品等级为 品.
【计算过程】
【总结反思】
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是 .
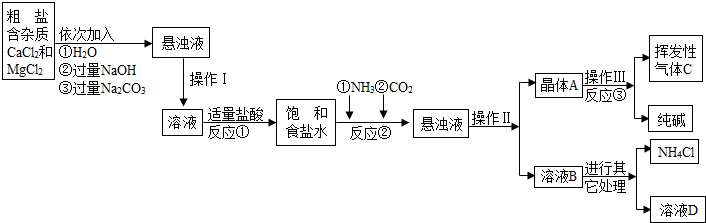
【产品与原理】
该厂采用“侯氏制碱法”生产化工产品--纯碱(Na2CO3)和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为:
NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl;分离出NaHCO3,加热制得纯碱.
【生产流程】

【相关资料】
(1)NH4Cl
| ||
(2)已知20℃时有关物质的溶解度如下
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
【问题讨论】:
(1)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为
(2)反应①中发生了两个反应,写出其中的一个化学方程式:
(3)反应③中得到纯碱的化学方程式为:
(4)溶液B中的溶质有
(5)上述生产流程中可循环使用的是
A.挥发性气体C; B.溶液D; C.氢氧化镁;D.化肥NH4Cl
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质
【含量测定】
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,
请通过计算并结合右表判断此纯碱样品等级为
【计算过程】
| 工业纯碱标准:(Na2CO3≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是