题目内容
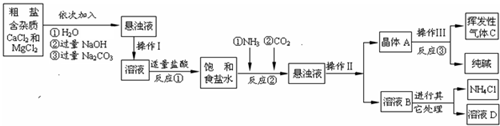
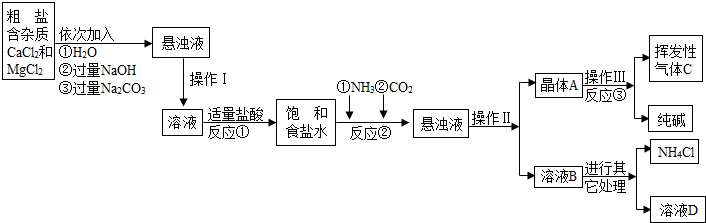
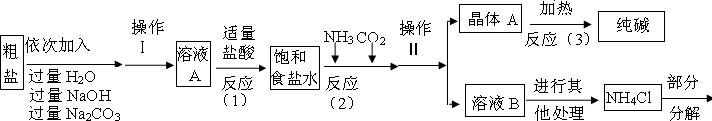
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.【产品与原理】
该厂采用“侯氏制碱法”生产化工产品--纯碱(Na2CO3)和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为:
NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl;分离出NaHCO3,加热制得纯碱.
【生产流程】
【相关资料】
(1)NH4Cl
| ||
(2)已知20℃时有关物质的溶解度如下
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
【问题讨论】:
(1)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为
(2)反应①中发生了两个反应,写出其中的一个化学方程式:
(3)反应③中得到纯碱的化学方程式为:
(4)溶液B中的溶质有
(5)上述生产流程中可循环使用的是
A.挥发性气体C; B.溶液D; C.氢氧化镁;D.化肥NH4Cl
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质
【含量测定】
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,
请通过计算并结合右表判断此纯碱样品等级为
【计算过程】
| 工业纯碱标准:(Na2CO3≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是
分析:问题讨论(1)欲使悬浊液变为溶液,可过滤掉其中的不溶物;
(2)根据盐的溶解性可知,在第一次反应后溶液中只剩NaCl、Na2CO3、NaOH,所以在加入盐酸后Na2CO3、NaOH可与盐酸反应生成NaCl等;
(3)纯碱就是碳酸钠,所以其化学式就是Na2CO3;
(4)根据题干中提供的侯氏制碱法的反应原理可分析得出答案,另外值得注意的是NaHCO3不会全部析出,肯定会有部分溶解在溶液中;
(5)挥发性气体C是二氧化碳,溶液D是可能含有NaCl等多种溶质的混合物,因为给出的信息不足无法判断其具体组成,但二氧化碳和氯化钠在上述生产流程中都可以循环使用;
(组成确定)
(2)欲知纯碱样品含有的杂质,可用反向思维方法,先确定白色沉淀,再推断杂质是什么;
(含量测定)利用化学方程式可以求出纯碱的质量,用
×100%可计算出纯度,再与工业纯碱标准对照,即可知道属于哪类产品;
(总结反思) 等质量的碳酸钠与氯化钡反应产生的碳酸钡沉淀质量大,称量时的(相对)误差小.
(2)根据盐的溶解性可知,在第一次反应后溶液中只剩NaCl、Na2CO3、NaOH,所以在加入盐酸后Na2CO3、NaOH可与盐酸反应生成NaCl等;
(3)纯碱就是碳酸钠,所以其化学式就是Na2CO3;
(4)根据题干中提供的侯氏制碱法的反应原理可分析得出答案,另外值得注意的是NaHCO3不会全部析出,肯定会有部分溶解在溶液中;
(5)挥发性气体C是二氧化碳,溶液D是可能含有NaCl等多种溶质的混合物,因为给出的信息不足无法判断其具体组成,但二氧化碳和氯化钠在上述生产流程中都可以循环使用;
(组成确定)
(2)欲知纯碱样品含有的杂质,可用反向思维方法,先确定白色沉淀,再推断杂质是什么;
(含量测定)利用化学方程式可以求出纯碱的质量,用
| 纯碱质量 |
| 样品质量 |
(总结反思) 等质量的碳酸钠与氯化钡反应产生的碳酸钡沉淀质量大,称量时的(相对)误差小.
解答:解:(共15分)
【问题讨论】:
(1)固体小颗粒悬浮于液体里形成的混合物叫悬浊液,欲使悬浊液变为溶液,可过滤掉其中的不溶物,故操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为过滤.(1分)
(2)由图可知,反应①中与盐酸反应的物质有NaOH和Na2CO3,故反应方程式为:NaOH+HCl═NaCl+H2O或Na2CO3+2HCl=2NaCl+H2O+CO2↑(2分)
(3)由图可知,晶体A为2NaHCO3,所以反应③中得到纯碱的化学方程式为:2NaHCO3
Na2CO3+H2O+CO2↑(2分)
(4)由图可知,溶液B中的溶质有NaHCO3、NaCl、NH4Cl、NH4HCO3四种,故答案为其中的任意两种(2分),(写名称或名称符号混写也可.只写1个且正确给(1分),只要写错1个就不给分)
(5)挥发性气体C是二氧化碳,溶液D是可能含有NaCl等多种溶质的混合物,因为给出的信息不足无法判断其具体组成,但二氧化碳和氯化钠在上述生产流程中都可以循环使用(2分),(选对1个给(1分),只要选错1个不给分)
【组成确定】:
(2)由题意可知,滴加AgNO3溶液,有白色沉淀,此沉淀即AgCl,所以反应物中一定有Cl根离子,由题意可知,向该溶液中加入过量稀HNO3反应物,并且样品完全溶于水,由此可以推断纯碱样品含有杂质NaCl;(1分)
【含量测定】(除计算过程(3分)外,其余每空(1分).)
合格(1分)
解:设Na2CO3的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl(1分)
106 100
x 10.0g
106:100=x:10.0g
解得:x=10.6g(1分)
×100%≈98.1%,与工业纯碱标准对照,属于合格品;
【总结反思】等质量的碳酸钠与氯化钡反应产生的碳酸钡沉淀质量大,称量时的(相对)误差小
【问题讨论】:
(1)固体小颗粒悬浮于液体里形成的混合物叫悬浊液,欲使悬浊液变为溶液,可过滤掉其中的不溶物,故操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为过滤.(1分)
(2)由图可知,反应①中与盐酸反应的物质有NaOH和Na2CO3,故反应方程式为:NaOH+HCl═NaCl+H2O或Na2CO3+2HCl=2NaCl+H2O+CO2↑(2分)
(3)由图可知,晶体A为2NaHCO3,所以反应③中得到纯碱的化学方程式为:2NaHCO3
| ||
(4)由图可知,溶液B中的溶质有NaHCO3、NaCl、NH4Cl、NH4HCO3四种,故答案为其中的任意两种(2分),(写名称或名称符号混写也可.只写1个且正确给(1分),只要写错1个就不给分)
(5)挥发性气体C是二氧化碳,溶液D是可能含有NaCl等多种溶质的混合物,因为给出的信息不足无法判断其具体组成,但二氧化碳和氯化钠在上述生产流程中都可以循环使用(2分),(选对1个给(1分),只要选错1个不给分)
【组成确定】:
(2)由题意可知,滴加AgNO3溶液,有白色沉淀,此沉淀即AgCl,所以反应物中一定有Cl根离子,由题意可知,向该溶液中加入过量稀HNO3反应物,并且样品完全溶于水,由此可以推断纯碱样品含有杂质NaCl;(1分)
【含量测定】(除计算过程(3分)外,其余每空(1分).)
合格(1分)
解:设Na2CO3的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl(1分)
106 100
x 10.0g
106:100=x:10.0g
解得:x=10.6g(1分)
| 10.6 |
| 10.8 |
【总结反思】等质量的碳酸钠与氯化钡反应产生的碳酸钡沉淀质量大,称量时的(相对)误差小
点评:本题主要测试学生对实验操作过程的掌握,以及根据反应的化学方程式进行计算的能力.学生必须有牢固的知识,才能顺利解答.

练习册系列答案
相关题目
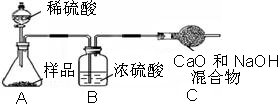 小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为
小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为