题目内容
【题目】请结合下图回答问题:

(1)写出仪器的名称:①________。
(2)实验室可用(NH4)2SO4固体和熟石灰混合加热制取NH3,应选择的发生装置为_____(选填序号)。
(3)实验室用氯酸钾和二氧化锰制备氧气的化学式表达式是_____________能收集氧气的装置有
___________(填编号)
氧气收集完毕后,测得其纯度明显偏低,原因可能是:_______(填字母,可多选);
A.氯酸钾中混入了二氧化锰 B.收集前,集气瓶中未注满水
C.收集后,集气瓶中仍有少量水 D.加热前就将发生装置和收集装置连接好
(4)二氧化碳是一种温室气体。某化学兴趣小组利用如下图所示装置对二氧化碳的性质进行验证:
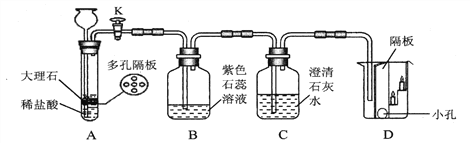
发生装置A的优点是______________。
当打开K,反应一段时间后:
①D烧杯中 ________(填“上层”或“下层”)的蜡烛先熄灭,说明二氧化碳具有的物理性质是______,化学性质是______。
②B处紫色石蕊溶液变成红色,C处澄清石灰水变浑浊。B处使紫色石蕊变红的物质是_________;C处反应的化学式表达式为_______。
(5)某同学欲测定一定质量的大理石粉末与盐酸充分反应后生成二氧化碳的体积,实验室制备二氧化碳的反应原理的化学式表达式是____________,其设计如图甲所示装置进行实验:

【实验步骤】
① 连接仪器,___________________;
② 将实验所用药品装入各仪器中,记录量气管初始刻度;
③ 打开分液漏斗活塞,加入足量稀盐酸至不再有气泡冒出。
在实验过程中,若烧瓶和量气管内气体压强过大,可将水准管_________(填“上提”或“下移”)。
④ 等恢复至室温,并________________后,再次记录量气管刻度;
【交流讨论】利用甲装置,即使操作无失误,由于加入的酸要占一定体积,也会导致测量结果偏大,某同学重新设计了一个如图乙的实验装置,利用该装置实验时,在气密性良好的前提下,如果往锥形瓶中注入的稀盐酸体积为V1 mL,充分反应后,右侧针筒中气体的读数为V2 mL,则反应生成的二氧化碳的体积为__________ mL。
(6)催化剂在生产、生活和科研中的地位越来越重要。实验室用过氧化氢溶液分解制取氧气时,就常用二氧化锰作催化剂。
【提出问题】红砖粉能作过氧化氢分解的催化剂吗?
【提出猜想】甲同学认为红砖粉可以代替MnO2作过氧化氢溶液分解的催化剂。
【设计实验】
①在试管中加入10mL6%的过氧化氢溶液,将带火星的木条伸入试管中;
②准确称量0.5g红砖粉,并放入另一支试管中,将带火星的木条伸入试管中;
③在步骤②的试管中加入10mL 6%过氧化氢溶液,将带火星木条伸入试管中;
④待步骤③的试管中无气泡冒出后,经过操作A、洗涤、干燥、称量得粉末仍为0.5g;
⑤另取10mL6%过氧化氢溶液,加入步骤④中所得固体,将带火星木条伸入试管。
【问题讨论】
a.步骤①中的现象为_________,步骤③、⑤中带火星的木条复燃。
b.步骤④中操作A的名称是_________。若提供了铁架台、玻璃棒、烧杯还缺少的玻璃仪器为_________,其中玻璃棒的作用为________。
c. 步骤⑤实验的目的为_________。
【实验结论】:________。
【答案】 铁架台 A 略 d BD 能控制反应的发生和停止 下层 密度大于空气 不可燃 不助燃 H2CO3(碳酸) CO2 +Ca(OH)2→CaCO3 +H2O CaCO3 +HCl→CaCl2+ CO2 +H2O 检查装置气密性 下移 调整水准管使左右液面相平 V2-V1 带火星的木条不复燃 过滤 漏斗 引流 探究红砖粉的化学性质是否改变 红砖粉能作过氧化氢分解的催化剂
【解析】(1) 根据常用仪器的名称和用途判断可知①是铁架台;(2) 实验室可用(NH4)2SO4固体和熟石灰混合加热制取NH3,属于固体加热型,应选择发生装置为A; (3) 实验室用氯酸钾和二氧化锰制备氧气的化学式表达式是:2KClO3![]() MnO2 2KCl+3O2↑,氧气可用向上排空气法和排水法收集,结合图中的收集装置,只能选用:b;A.氯酸钾中混入了二氧化锰,二氧化锰加快了反应速率,但对生成氧气的纯度没有影响,故不符合题意;B.收集前,集气瓶中未注满水,就会留有气泡,使收集的氧气纯度偏低,符合题意;C.收集后,集气瓶中仍有少量水,只会导致氧气没有收集满,对生成氧气的纯度没有影响,故不符合题意;D.加热前就将发生装置和收集装置连接好,会把装置内的少量空气收集到集气瓶内,使收集的氧气纯度偏低,符合题意;故选BD;(4) 发生装置A的优点是:能控制反应的发生和停止;①二氧化碳密度比空气大,且不能燃烧,也不支持燃烧,所以D烧杯中下层蜡烛先熄灭;②二氧化碳与水反应生成碳酸,碳酸可使石蕊变红,二氧化碳不能使石蕊变红;二氧化碳与石灰水反应生成碳酸钙沉淀和水,方程式是Ca(OH)2+CO2═CaCO3↓+H2O;(5)大理石和盐酸反应生成氯化钙、水和二氧化碳,反应方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑; ①连接仪器后,应检查装置气密性;③在实验过程中,若烧瓶和量气管内气体压强过大,可将水准管下移保持压强相同;④等恢复至室温,并调整水准管使左右液面相平后,再次记录量气管刻度;【交流讨论】由实验的过程可知,反应生成的二氧化碳的体积为 V2-V1mL;【问题讨论】a.步骤①中的现象为带火星的木条不能复燃,步骤③、⑤中带火星的木条复燃;b.步骤④中操作A的名称是干燥;c.步骤⑤实验的目的为验证红砖粉在反应前后的化学性质是否改变;【实验结论】根据以上分析可知红砖粉能作过氧化氢分解的催化剂。
MnO2 2KCl+3O2↑,氧气可用向上排空气法和排水法收集,结合图中的收集装置,只能选用:b;A.氯酸钾中混入了二氧化锰,二氧化锰加快了反应速率,但对生成氧气的纯度没有影响,故不符合题意;B.收集前,集气瓶中未注满水,就会留有气泡,使收集的氧气纯度偏低,符合题意;C.收集后,集气瓶中仍有少量水,只会导致氧气没有收集满,对生成氧气的纯度没有影响,故不符合题意;D.加热前就将发生装置和收集装置连接好,会把装置内的少量空气收集到集气瓶内,使收集的氧气纯度偏低,符合题意;故选BD;(4) 发生装置A的优点是:能控制反应的发生和停止;①二氧化碳密度比空气大,且不能燃烧,也不支持燃烧,所以D烧杯中下层蜡烛先熄灭;②二氧化碳与水反应生成碳酸,碳酸可使石蕊变红,二氧化碳不能使石蕊变红;二氧化碳与石灰水反应生成碳酸钙沉淀和水,方程式是Ca(OH)2+CO2═CaCO3↓+H2O;(5)大理石和盐酸反应生成氯化钙、水和二氧化碳,反应方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑; ①连接仪器后,应检查装置气密性;③在实验过程中,若烧瓶和量气管内气体压强过大,可将水准管下移保持压强相同;④等恢复至室温,并调整水准管使左右液面相平后,再次记录量气管刻度;【交流讨论】由实验的过程可知,反应生成的二氧化碳的体积为 V2-V1mL;【问题讨论】a.步骤①中的现象为带火星的木条不能复燃,步骤③、⑤中带火星的木条复燃;b.步骤④中操作A的名称是干燥;c.步骤⑤实验的目的为验证红砖粉在反应前后的化学性质是否改变;【实验结论】根据以上分析可知红砖粉能作过氧化氢分解的催化剂。
