题目内容
【题目】为了对氯化钾样品(含少量KNO3)进行组分分析,甲、乙、丙三位同学分别进行实验,它们的实验数据如下表.请仔细观察和分析数据,回答下列问题.
甲 | 乙 | 丙 | |
所取固体样品的质量(g) | 20 | 10 | 10 |
加入AgNO3溶液的质量(g) | 100 | 100 | 150 |
反应后所得沉淀的质量(g) | 14.35 | 14.35 | 14.35 |
(1)样品中氯化钾的质量分数是____?(小数点后面保留两位数,下同)
(2)三位同学分别把反应后的溶液过滤,哪一位同学所得的滤液是只含一种溶质的溶液?此溶液的溶质质量分数是____?
【答案】⑴74.5% ⑵ 乙;13.2%(分析表中数据可知10g样品和100g硝酸银溶液恰好完全反应)
【解析】
试题由生成沉淀的质量,根据硝酸银与氯化钾反应的化学方程式可以计算出样品中氯化钾的质量和生成硝酸钾的质量,进而计算出样品中氯化钾的质量分数。根据硝酸银与氯化钾反应的化学方程式可知,只有恰好完全反应时,所得溶液中的溶质和原固体中所含的杂质才是同一种物质。所得溶液中溶质的质量由生成的硝酸钾和固体中含有的硝酸钾两部分组成;所得溶液的质量=固体质量+硝酸银溶液的质量-生成沉淀的质量;最后根据溶质质量分数的计算公式可以计算出所得溶液中溶质的质量分数。
甲、乙两组数据对照,说明甲中固体过量,硝酸银溶液完全反应;乙、丙两组数据对照,说明丙中硝酸银溶液过量,固体完全反应;以上分析说明乙中固体与硝酸银溶液恰好完全反应,计算时应以乙组数据为准。
(1)设样品中氯化钾的质量分数为x,生成硝酸钾的质量为y
KCl + AgNO3 = AgCl↓ + KNO3
74.5 143.5 101
10g×x 14.35g y
![]()
解得,x=74.50%,y=10.1g
(2)所得溶液中溶质的质量分数为
![]() ×100%≈13.23%
×100%≈13.23%
答:(1)样品中氯化钾的质量分数为74.50%;
(2)乙同学所得的滤液是只含一种溶质的溶液,且所得溶液中溶质的质量分数为13.23%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】为探究CO2与NaOH溶液发生的反应,某兴趣小组尝试用不同的方式进行实验。
(查阅资料)
20℃时,几种物质在水中的溶解度见表:
物质 | Na2CO3 | NaHCO3 | Ca(OH)2 | Ba(OH)2 |
溶解度/g | 21.5 | 9.6 | 0.165 | 3.89 |
(实验探究)
(1)实验一:小雨取一充满CO2的矿泉水瓶,加入一定量的水,立即拧紧瓶盖,振荡,发现瓶子变瘪,小雨另取一相同的充满CO2的矿泉水瓶,向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X,此时观察到的现象是_____。
(2)实验二:为检验CO2与NaOH溶液反应的产物,小亮取实验一所得溶液X少许,向其中滴加BaCl2溶液,有白色沉淀产生,该反应的化学方程式为_____。实验中不宜将BaCl2溶液换成CaCl2溶液的原因是_____。
(3)实验三:小华取实验一所得溶液X少许,向其中加入过量的BaCl2溶液,振荡,静置,取上层清液,滴入1滴酚酞试液,发现溶液呈_____色,证明溶液X中有NaOH剩余。实验中,小华没有直接向少量溶液X中滴入酚酞试液,理由是_____。
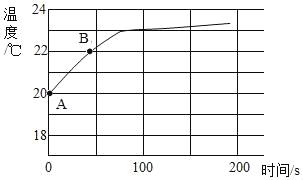
(4)实验四:兴趣小组将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测定反应过程中温度变化,结果如图所示。图中,AB段温度变化的原因是_____。
(反思感悟)
(5)实验从CO2减少、NaOH减少、Na2CO3生成等物质的变化,以及_____转化等视角多维度探究CO2与NaOH发生了反应,对于现象不明显的化学反应,可以通过现代技术手段进行数据测定,实现反应过程的“可视化”。