��Ŀ����
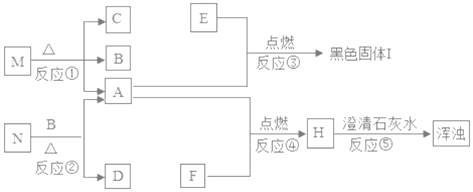
����Ŀ����ͼ��һЩ��������֮���ת����ϵ������A ����ʹ������ľ����ȼ�����壻B�ڷ�Ӧǰ���������ͻ�ѧ���ʶ��������仯��E�������г����Ľ������ʣ�E������A�е�ȼ��ʱ�������䣬���ɺ�ɫ���塣
�������ѧ���ݣ��ش��������⣺
��1��д������M��N�����ƣ�M_____��N_____��
��2��д���������ʵĻ�ѧʽ��
A_____�� B_____�� H_____�� I_____��
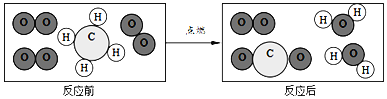
��3���������ʵĻ��������з��ӡ�ԭ�ӡ��������֡�������D����_____������ӡ�����ԭ�ӡ��������ӡ������ɵġ�
��4����Ӧ_____������Ţ١��ݣ���ʵ���ҳ�������֤ij�����Ƿ�Ϊ������̼��
��5��Fe3O4����Ԫ�صĻ��ϼ�Ϊ_____��ʵ����Fe3O4����Ԫ�س�+2��+3�ۣ����ǿ��Խ�Fe3O4д��FeOFe2O3���Ժ����ǻ���֪����Fe3O4Ҳ����д��[Fe��Fe2O4��]������![]() �У����������ŵ�Fe�Ļ��ϼ�Ϊ_____�ۡ�
�У����������ŵ�Fe�Ļ��ϼ�Ϊ_____�ۡ�
���𰸡�������� ����� O2�� MnO2 CO2 Fe3O4 ���� �� +![]() +3
+3
��������
A ����ʹ������ľ����ȼ����������A��������B���ڷ�Ӧǰ���������ͻ�ѧ���ʶ��������仯������B��������N�ֽܷ�������������B�Ƕ������̣���M�Ǹ�����أ�C������ء�E�ǽ��������������ڵ�ȼ�������·�Ӧ���ɺ�ɫ�Ĺ��壬��E������I��������������H��ʹ����ʯ��ˮ����ǣ���H�Ƕ�����̼��N�ڶ��������������������¼��ȷֽ�������������N������ء�
��1�������Ϸ�����֪��M�Ǹ�����أ�N������ء�
��2���ɷ�����֪��A����������ѧʽΪ��O2��B�Ƕ������̣���ѧʽΪ��MnO2��H�Ƕ�����̼����ѧʽΪ��CO2��I����������������ѧʽΪ��Fe3O4��
��3������D���Ȼ��أ��ɼ����Ӻ������ӹ��ɡ�
��4����Ӧ���Ƕ�����̼�����ʯ��ˮ��Ӧ�����Լ��������̼��
��5��Fe3O4����Ԫ�صĻ��ϼ�Ϊ-2�ۣ����ݻ��ϼ۵Ĵ�����Ϊ0����Ԫ�صĻ��ϼ�Ϊ+![]() ��
��![]() �У����������ŵ�Fe�Ļ��ϼ���Fe2O3�����Ļ��ϼ���ͬ���ʻ��ϼ�Ϊ+3����
�У����������ŵ�Fe�Ļ��ϼ���Fe2O3�����Ļ��ϼ���ͬ���ʻ��ϼ�Ϊ+3����

 �Ķ��쳵ϵ�д�
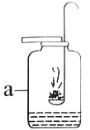
�Ķ��쳵ϵ�д�����Ŀ��ͨ������ʵ�����ƶ����ʵ��������ʶ���ʵ�һ�ַ������о�ˮ����ɾ������������ַ��������ˮʵ������ͼ��ʾ��
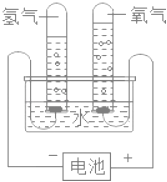
��1�������飬���ˮֻ������������������ȷ����ˮ����_____��_____��ɵĽ��ۣ��ó��˽��۵�������_____��
��2����֪��ͬ״���£���ͬ������κ����������ͬ��Ŀ�ķ��ӡ����ڵ��ˮʱ���������������������Ϊ2��1�������ˮ������_____��_____�ĸ�����Ϊ2��1������һ����ѧȷ�ϣ��ó�ˮ�Ļ�ѧʽΪH2O��
��3�����ˮ�Ļ�ѧ����ʽΪ_____���÷�Ӧ�����ɵ�������������������Ϊ_____��
��4����ͬ�����£�������������ˮ�е��ܽ������Dz���ͬ�ģ�ÿ100gˮ���������ܽ�������������£�
�� �� | �� �� | �� �� |
ÿ100gˮ���������ܽ���������� | 1.63��10��3g | 4.34��10��3g |
����Ը�������ˮ��������_____���ɴ�����Ϊ��ˮ�ĵ������У���������������������ȿ���_____2��1������ڡ���С�ڡ�����