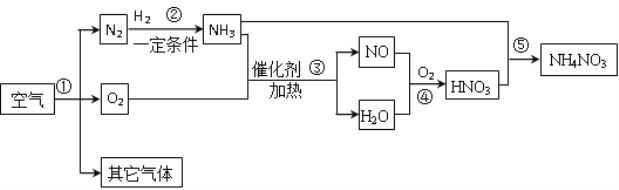
题目内容
【题目】某氯化钾溶液中可能含有碳酸钠、硫酸钠、盐酸中的一种或几种,为测定其成分,先后逐滴加入氯化钡溶液、稀硝酸,产生沉淀质量与时间的关系如图.下列说法正确的是

A. OA段发生了两个反应
B. B点对应的溶液溶质有两种
C. 原溶液中碳酸钠与硫酸钠的质量比为106:71
D. 根据信息可知:该氯化钾溶液中一定含有碳酸钠、硫酸钠,可能含有盐酸
【答案】AC
【解析】因为加入稀硝酸后沉淀质量减少,故开始生成的沉淀是硫酸钡、碳酸钡的混合物,即氯化钾溶液中含有碳酸钠、硫酸钠,有碳酸钠则无盐酸。A、OA段发生了两个反应,BaCl2 + Na2SO4=2NaCl + BaSO4↓, BaCl2 +Na2CO3==BaCO3↓+2NaCl,正确;B、B点对应的溶液溶质有氯化钾、氯化钠、氯化钡三种,错误;C、硫酸钡沉淀的质量为:2.33g,碳酸钡沉淀的质量为:6.27g-2.33g=3.94g,设原溶液中碳酸钠的质量为x,硫酸钠的质量为y
BaCl2 +Na2CO3==BaCO3↓+2NaCl BaCl2 + Na2SO4=2NaCl + BaSO4↓
106 197 142 233
x 3.94g y 2.33g
![]() =
=![]() 解得x=2.12g
解得x=2.12g ![]() =
=![]() 解得y=1.42g
解得y=1.42g
故原溶液中碳酸钠与硫酸钠的质量比为2.12g :1.42g= 106:71,正确;D、 根据信息可知:该氯化钾溶液中一定含有碳酸钠、硫酸钠,不含有盐酸,错误。故选AC。

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案【题目】现有一瓶无瓶盖的NaOH溶液。为确定其是否变质,同学们开始了以下探究。
【猜想假设】猜想一:没有变质,为NaOH溶液;猜想二:全部变质,为Na2CO3溶液。
猜想三:该溶液部分变质,为___________________溶液。
【查阅资料】Na2CO3溶液呈碱性,CaCl2溶液呈中性。
【设计方案】请你完善下表几组同学探讨的设计方案。
实验操作 | 可能出现的现象与结论 | 同学评价 | |
第1组 |
| 溶液变红,则猜想一成立。 | 第2组同学认为:此方案结论不正确,理由 是:__________。 |
第2组 |
| 产生白色沉淀,反应方程式是:__________________, 则猜想一不成立。 | 第3组同学认为:此方 案还不能确定猜想二还是猜想三成立。 |
第3组 |
第一步 第二步 | 滤液变红,则猜想____成立。 | 第1组同学认为:不需过滤也能达到实验目的,更简单的操作方法是:____________。 |
【探究实验】综合各小组的方案后,动手实验。
【结论与反思】NaOH溶液易与空气中CO2反应而变质,所以要________保存。
【拓展延伸】同学们设计了下列两套装置进行实验:用胶头滴管吸取某种液体,锥形瓶中充入一种气体或放入一种固体物质,挤压胶头滴管。一段时间后,两装置中气球明显胀大。

(1)若甲中充入的气体是CO2,则可能发生反应的方程式_______________。(任写一个)
(2)若乙中胶头滴管吸取的是稀盐酸,则锥形瓶中放入的固体可能是___。(任写一种)