题目内容
在牙膏和一些药品中常用优质碳酸钙粉末作填充剂或载体.而优质碳酸钙粉末的制作通常是按下列程序:先将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰水,然后将净化后的石灰水与二氧化碳作用得到碳酸钙.(注:石灰石在煅烧时受高温分解,除了产生氧化钙,还产生了一种可以产生温室效应的气体物质)
(1)试用化学方程式表示上述反应的原理
(2)计算:
①碳酸钙(CaCO3)的相对分子质量是
②200t含碳酸钙70%的石灰石中,碳酸钙的质量是
③往50g、7.4%的澄清的石灰水里通入二氧化碳.至少通入了g的二氧化碳,才能将其中的氢氧化钙全部转化为碳酸钙.
【答案】分析:可以根据物质的化学式求相对分子质量,根据质量守恒定律可以正确书写化学方程式,根据化学方程式可以碱性综合运算等等.
解答:解:(1)碳酸钙在高温下生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙和水.
化学方程式为:CaCO3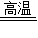 CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+CO2═CaCO3↓+H2O.
CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+CO2═CaCO3↓+H2O.
(2)碳酸钙的相对分子质量为:40+12+16×3=100.
200t含碳酸钙70%的石灰石中,碳酸钙的质量是:200t×70%=140t.
设通入二氧化碳的质量为X.
Ca(OH)2+CO2═CaCO3↓+H2O
74 44
50g×7.4% X
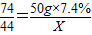
X=2.2g
答:至少需要二氧化碳的质量是2.2g.
点评:本题再用考查了化学方程式的书写及其根据化学方程式计算等方面的内容.
解答:解:(1)碳酸钙在高温下生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙和水.
化学方程式为:CaCO3
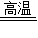 CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+CO2═CaCO3↓+H2O.
CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+CO2═CaCO3↓+H2O.(2)碳酸钙的相对分子质量为:40+12+16×3=100.
200t含碳酸钙70%的石灰石中,碳酸钙的质量是:200t×70%=140t.
设通入二氧化碳的质量为X.
Ca(OH)2+CO2═CaCO3↓+H2O
74 44
50g×7.4% X
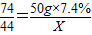
X=2.2g
答:至少需要二氧化碳的质量是2.2g.
点评:本题再用考查了化学方程式的书写及其根据化学方程式计算等方面的内容.

练习册系列答案
相关题目