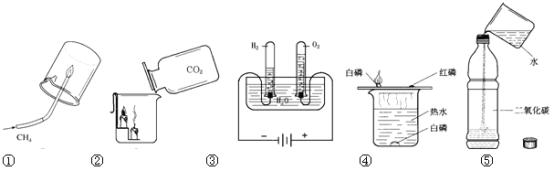
题目内容
【题目】水是生命之源、万物之基,是人类宝贵的自然资源。
(1)水的净化河水净化的主要步骤如图所示。有关说法错误的是________
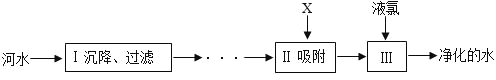
A 步骤Ⅰ可除去难溶性杂质
B X 试剂可以是活性炭
C 步骤Ⅲ可杀菌消毒
D 净化后的水是纯净物
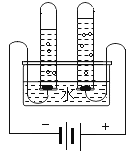
(2)水的组成如图是电解水的实验图,通过电解水的实验得出了水的组成。请写出电解水的化学方程式为________,电解时收集到正极、负极气体的质量比为________。
(3)水的用途(如图)
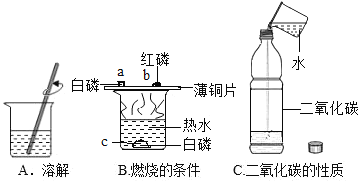
①实验 A 中水作 ____________(填“溶剂”或“溶质”)。
②实验 B 中水的作用是提供热量和 ________。
③实验 C 中的水作反应物,与二氧化碳反应生成________(写名称)。
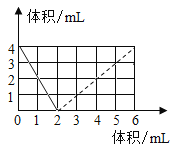
(4)水的溶液水可以作为溶剂溶解多种物质,如图是甲、乙、丙 三种物质的溶解度曲线。

①图中甲和丙的交点的意义是________________。
②t1℃时,等质量的甲、乙饱和溶液,其中所含溶质的质量:甲________ 乙(填“大于”、“等于”、“小于”)。
③t2℃时,将 20g 丙溶解于 50g 水中,形成________g 溶液,溶液的溶质质量分数为 ____________(保留到 0.1%)。
④分别将 t2℃时甲、乙、丙三种物质的饱和溶液升温至 t3℃,所得 溶液溶质质量分数的大小关系为:____________(从大到小排列)。
⑤M 点代表 t3℃时甲的 ____________溶液(填“饱和”或“不饱和”),若要将组成在 M 点的甲溶液转变为N 点的甲溶液,可采取____________方法。若将甲溶液从状态 A 改变为 N 有多种途径, 试设计并简述一操作最简单、结果最准确的实验途径:先将 A 点的甲的饱和溶液降温到 t2℃,____,再将溶液升温至 t3℃。
【答案】D 2 H2O![]() 2 H2↑+ O2 ↑ 8:1 溶剂 隔绝氧气 碳酸 t2℃时,甲和丙的溶解度相等均为30g 小于 65 23.1% 乙>甲>丙 饱和 加水(或加溶剂) 过滤除去析出的晶体
2 H2↑+ O2 ↑ 8:1 溶剂 隔绝氧气 碳酸 t2℃时,甲和丙的溶解度相等均为30g 小于 65 23.1% 乙>甲>丙 饱和 加水(或加溶剂) 过滤除去析出的晶体
【解析】
(1)A、过滤能除去不溶性固体杂质,故步骤Ⅰ可出去难溶性杂质,正确;
B、活性炭具有吸附性,能除去水中的色素和异味,正确;
C、液氯能杀菌,故步骤Ⅲ可杀菌、消毒,正确;
D、纯净水是不含有杂质的水,经过这几步净化的水中含有可溶性杂质,不是纯净物,错误;
故选:D。
(2)在通电的条件下,水分解为氢气和氧气,化学方程式为2H2O![]() 2H2↑+O2↑,连接电源正极的产生的是氧气,连接电源负极的产生的是氢气,由化学方程式可知,生成氧气与氢气的质量比为:32:4=8:1;故填:2H2O
2H2↑+O2↑,连接电源正极的产生的是氧气,连接电源负极的产生的是氢气,由化学方程式可知,生成氧气与氢气的质量比为:32:4=8:1;故填:2H2O![]() 2H2↑+O2↑;8:1;
2H2↑+O2↑;8:1;
(3)在溶解过程中,水可以作溶剂,所以实验A中水作溶剂;
②实验B中水的作用是提供热量和隔绝氧气;
③实验C中二氧化碳和水反应生成碳酸;
故填:①溶剂;②隔绝氧气;③碳酸;
(4)①图中甲和丙的交点的意义是:t2℃时,甲和丙的溶解度相等均为30g。故填:t2℃时,甲和丙的溶解度相等均为30g;
②t1℃时,甲的溶解度小于乙,根据饱和溶液质量分数=![]() 可知,甲的饱和溶液质量分数小于乙的饱和溶液质量分数,又因为溶质的质量=溶液的质量×溶液的质量分数,所以等质量的甲、乙饱和溶液,其中所含溶质的质量:甲小于乙。故填:小于;
可知,甲的饱和溶液质量分数小于乙的饱和溶液质量分数,又因为溶质的质量=溶液的质量×溶液的质量分数,所以等质量的甲、乙饱和溶液,其中所含溶质的质量:甲小于乙。故填:小于;
③t2℃时,丙的溶解度为30g,将20g丙溶解于50g水中,只能溶解15g,形成65g溶液,溶液的溶质质量分数=![]() 。故填:65;23.1%;
。故填:65;23.1%;
④t2℃时,乙物质的溶解度最大,甲、丙物质的溶解度相等,此饱和溶液的质量分数乙最大,甲、丙饱和溶液质量分数相等;升高温度,甲、乙物质的溶解度增大,溶液中的组成不变,质量分数也不变,丙物质的溶解度减小,由溶质析出,溶液质量分数减小;所以将三种物质的饱和溶液从t2℃升温至t3℃时,所得溶液溶质质量分数的大小关系为乙>甲>丙。故填:乙>甲>丙;
⑤M点在甲的溶解度曲线上,代表 t3℃时甲的饱和溶液;N点在甲的溶解度曲线下方,为t3℃时甲的不饱和溶液,若要将组成在M点的甲溶液转变为N点的甲溶液,可采取加水的方法;从溶液状态分析,A溶液为低温时饱和溶液,N溶液为高温时的不饱和溶液,一般说来从A状态到N状态只需要升温。但N点的溶质比A点少,如果只进行升温A点将平行右移,不能到达N点,所以需要先通过降温至t2℃使A点移动到与N点平行的位置,滤出晶体后升高温度至t3℃,A点平行右移至N点。故填:饱和;加水(或加溶剂);过滤除去析出的晶体。

 期末集结号系列答案
期末集结号系列答案【题目】利用沉淀法可测定某粗盐样品的纯度(假定粗盐中的杂质全部是MgCl2)。每次取100 g样品配制成溶液,向其中加入质量分数为10%的氢氧化钠溶液,测得生成沉淀的质量与所加氢氧化钠溶液的质量关系如下表所示:
测定次数 | 第一次 | 第二次 | 第三次 | 第四次 |
样品质量/g | 100 | 100 | 100 | 100 |
氢氧化钠溶液质量/g | 32 | 64 | 82 | 90 |
沉淀质量/g | 2.32 | 4.64 | 5.8 | 5.8 |
(1)求粗盐的纯度________。
(2)当样品与所加氢氧化钠溶液恰好完全反应时,求溶液中氯化钠的质量________。(写出解题过程)
【题目】某校同学开展了如图所示的“溶液酸碱性的检验”的实验活动.
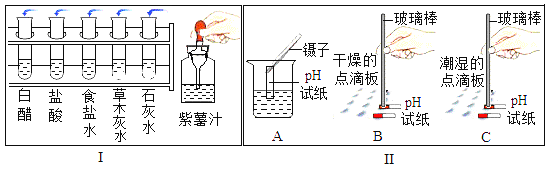
(1)把自制的紫色紫薯汁按图![]() 所示分别滴加到试管中,观察到的现象如下表所示:
所示分别滴加到试管中,观察到的现象如下表所示:
溶液 | 白醋 | 盐酸 | 蔗糖水 | 草木灰水 | 石灰水 |
加入紫薯汁后的颜色 | 红色 | 红色 | 紫色 | 绿色 | 绿色 |
①图![]() 中存放紫薯汁的仪器名称为________.
中存放紫薯汁的仪器名称为________.
②根据上表推测,紫薯汁能作酸碱指示剂,遇到稀硫酸可能显示的颜色是________.
(2)用pH试纸测定图![]() 中部分溶液的酸碱度:草木灰水
中部分溶液的酸碱度:草木灰水![]() ,属于________
,属于________![]() 填“酸性”“中性”或“碱性”
填“酸性”“中性”或“碱性”![]() 溶液;白醋pH________
溶液;白醋pH________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() .
.
(3)图![]() 是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是________
是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是________![]() 填“A”“B”或“C”,下同
填“A”“B”或“C”,下同![]() ,可能导致所测溶液pH发生改变的错误操作是________,如果测定的是石灰水,测得的pH将________
,可能导致所测溶液pH发生改变的错误操作是________,如果测定的是石灰水,测得的pH将________![]() 填“偏大”“不变”或“偏小”
填“偏大”“不变”或“偏小”![]() 简述正确测定溶液PH的操作步骤:________.
简述正确测定溶液PH的操作步骤:________.