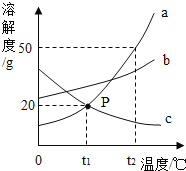
题目内容
【题目】A、B、C是初中化学常见的物质。在以下两种情况下,A、B、C中均有两种物质为氧化物。
(1)若向A中加入B物质,则生成C,C溶液pH>7,A、C含有相同的金属元素,该反应的化学方程式为_____。若将A放入饱和的C溶液中,出现白色浑浊,该白色浑浊物为_____。
(2)若A含四种元素,A可以通过发生分解反应同时生成B和C,则A的俗名为_____,该反应的化学方程式为_____。
【答案】CaO+H2O=Ca(OH)2 Ca(OH)2 小苏打 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
【解析】
(1)A、B、C三种初中常见物质,其中两种为氧化物,B为一种碱说明A、C属于氧化物,根所以A是氧化钙,B是氢氧化钙,C是水;A放入饱和的B溶液中,出现白色浑浊,原因是氧化钙与水反应生成氢氧化钙且放出热量导致溶液温度升高,饱和溶液水量减小且温度升高后溶液中的多余氢氧化钙(氢氧化钙的溶解度随温度的升高而降低)会以沉淀的形式出现,反应的方程式为CaO+H2O=Ca(OH)2;故填:CaO+H2O=Ca(OH)2;Ca(OH)2。
(2)若A含四种元素,A可以通过发生分解反应同时生成B和C,则A可能为碳酸氢钠,其俗名为小苏打,该反应的化学方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑。故填:小苏打,2NaHCO3
Na2CO3+H2O+CO2↑。故填:小苏打,2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】请从A或B两题中任选1个作答,若两题均作答,按A计分。
A | B |
火力发电厂常用石灰石浆吸收废气中的二氧化硫,以防止空气污染。反应化学方程式为: 2CaCO3+O2+2SO2===2CaSO4+2CO2若处理含有1.6 kg二氧化硫的废气,至少需要碳酸钙的质量为________ kg才能将其完全吸收。 | 原煤中含有硫,燃烧时生成的SO2会污染空气。测量SO2含量的化学方程式为:SO2+2H2O+I2=== H2SO4+2HI,取用原煤燃烧产生的工业废气样品1 m3,缓缓通过含碘(I2)1.27 mg的碘溶液,刚好完全反应。则该工业废气中SO2的含量为____mg/m3(假设工业废气中的其它物质不与碘反应)。 |