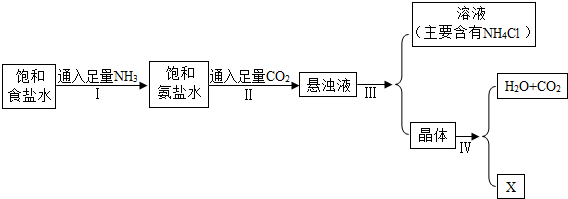
题目内容
工业上用侯氏制碱法制得的纯碱样品中含有一定量氯化钠,现称取只含氯化钠杂质的纯碱样品23.3g,放入盛有146g稀盐酸的烧杯中,恰好完全反应.反应后溶液的质量为160.5g,试计算:(1)样品中碳酸钠的质量;
(2)所用稀盐酸中溶质的质量分数.
分析:根据质量守恒定律可知,二氧化碳的质量等于反应前的纯碱和稀盐酸的质量之和减去反应后溶液的质量,然后写出化学方程式并代入数据计算即可.
解答:解:设碳酸钠的质量是X,氯化氢(盐酸的溶质)的质量是Y.
二氧化碳的质量等于146g+23.3g-160.5g═8.8g.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
X Y 8.8
═
得:X=21.2
═
得:Y=14.6
∴稀盐酸中溶质的质量分数═
×100%═10%
答:样品中碳酸钠的质量是21.2g,所用稀盐酸中溶质的质量分数为10%.
二氧化碳的质量等于146g+23.3g-160.5g═8.8g.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
X Y 8.8
| 106 |
| 44 |
| X |
| 8.8g |
得:X=21.2
| 73 |
| 44 |
| Y |
| 8.8g |
得:Y=14.6
∴稀盐酸中溶质的质量分数═
| 14.6g |
| 146g |
答:样品中碳酸钠的质量是21.2g,所用稀盐酸中溶质的质量分数为10%.
点评:学会化学方程式的计算方法和规范,注意二氧化碳的计算方法.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目