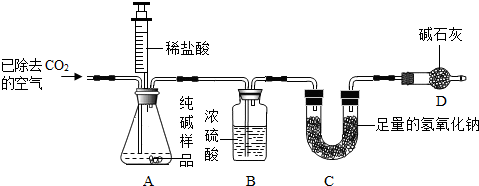
题目内容
侯德榜是在中国化学工业史上一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,以下是侯德榜先生制碱工业的简要流程:
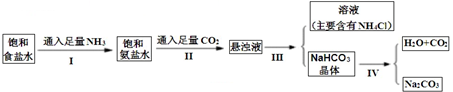
某化学兴趣小组对上述第Ⅲ步获得的晶体可能是NaCl Na2CO3 NaHCO3 (NH4)2CO3 NH4HCO3中的一种进行探究:
[提出问题]上述固体是什么物质?
[猜想与假设]
猜想1:NaCl
猜想2:NaHCO3
猜想3:(NH4)2CO3
猜想4
猜想5:NH4HCO3
[方案验证]
第Ⅳ步骤中有关化学反应方程式:2NaHCO3
X+CO2↑+H2O,其中X就是侯氏法制的碱,其组成
[反思与评介]
①第Ⅲ步操作名称为
②从第Ⅲ步所得溶液经过蒸发浓缩、

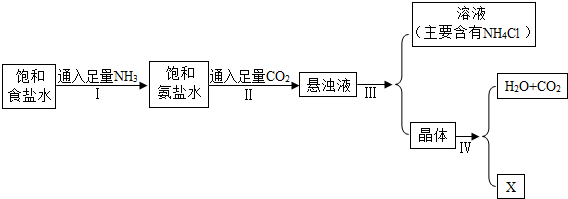
某化学兴趣小组对上述第Ⅲ步获得的晶体可能是NaCl Na2CO3 NaHCO3 (NH4)2CO3 NH4HCO3中的一种进行探究:
[提出问题]上述固体是什么物质?
[猜想与假设]
猜想1:NaCl
猜想2:NaHCO3
猜想3:(NH4)2CO3
猜想4
Na2CO3
Na2CO3
猜想5:NH4HCO3
[方案验证]
| 操作步骤 | 现象 | 结论 |
| (1)取该晶体加熟石灰研磨 | 无氨味 | 猜想 3和5 3和5 不成立 |
| (2)另取该晶体加入盐酸 | 有气泡产生 有气泡产生 |
猜想1不成立 |
| (3)另取少量该晶体加水溶解,再滴入氯化钙溶液 | 无白色沉淀 | 猜想4不成立 |
(4)另取该固体放入如图试管中加热 |
包有硫酸铜的棉花变 蓝色 蓝色 色,石灰水变浑浊 浑浊 |
综合(1)、(2)、(3)的结论得出猜想2成立 |
| ||
Na2CO3
Na2CO3
(填化学式),属于盐
盐
类(填“酸、碱、盐和氧化物”),其水溶液呈碱性
碱性
(填“酸性”、“碱性”或“中性”)[反思与评介]
①第Ⅲ步操作名称为
过滤
过滤
②从第Ⅲ步所得溶液经过蒸发浓缩、
降温
降温
、过滤,可分离得氯化铵晶体,氯化铵在农业上可作氮肥用.分析:[猜想与假设]根据可能是NaCl Na2CO3 NaHCO3 (NH4)2CO3 NH4HCO3中的物质进行猜想;[方案验证]晶体加熟石灰研磨如果有氨味跑出,说明晶体中含有铵根,如果没有则不含有铵根;加入盐酸有气泡产生含有碳酸根离子或碳酸氢根离子,如果没有气泡则不存在碳酸根离子和碳酸氢根离子;滴入氯化钙溶液有白色沉淀产生,说明有碳酸根离子,否则没有碳酸根离子;硫酸铜遇水变蓝色,二氧化碳能使澄清石灰水变浑浊,根据质量守恒定律反应前后各种原子数目和种类不变求出化学式;盐是指电离出金属离子和酸根离子的化合物,不溶于液体的固体和液体分离的方法是过滤;根据溶液中溶质结晶析出的方法进行判断.
解答:解:[猜想与假设]在所给的五种物质中只有碳酸钠没有,所以猜想是碳酸钠;
[方案验证]晶体加熟石灰研磨没有氨味,说明则不含有铵根,而猜想3和5中含有铵根,所以这两个猜想错误;加入盐酸有气泡产生含有碳酸根离子或碳酸氢根离子,如果没有气泡则不存在碳酸根离子和碳酸氢根离子,所给猜想中只有猜想1中加入盐酸不能产生气泡,结论是猜想1不成立,说明加入盐酸有气泡产生;碳酸氢钠受热分解生成碳酸钠、水、二氧化碳,硫酸铜遇水变蓝色,二氧化碳能使澄清石灰水变浑浊;
在2NaHCO3
X+CO2↑+H2O中反应物分子中含有2个钠原子、2个氢原子、2个碳原子、6个氧原子,生成物分子中已经有了2个氢原子、1个碳原子、3个氧原子,还少2个钠原子、1个碳原子、3个氧原子,所以化学式是Na2CO3,碳酸钠电离出金属钠离子和碳酸根离子,属于盐并且显碱性,它的俗称是纯碱显碱性;
[反思与评介]①不溶于液体的固体和液体分离的方法是过滤;②由于碳酸钠的溶解度受温度影响较大,析出晶体的方法是冷却热饱和溶液,要先蒸发浓缩、再降温析出晶体后再过滤.
故答案为:[猜想与假设]Na2CO3;[方案验证]
Na2CO3;盐;碱性;[反思与评介]①过滤;②降温.
[方案验证]晶体加熟石灰研磨没有氨味,说明则不含有铵根,而猜想3和5中含有铵根,所以这两个猜想错误;加入盐酸有气泡产生含有碳酸根离子或碳酸氢根离子,如果没有气泡则不存在碳酸根离子和碳酸氢根离子,所给猜想中只有猜想1中加入盐酸不能产生气泡,结论是猜想1不成立,说明加入盐酸有气泡产生;碳酸氢钠受热分解生成碳酸钠、水、二氧化碳,硫酸铜遇水变蓝色,二氧化碳能使澄清石灰水变浑浊;
在2NaHCO3
| ||
[反思与评介]①不溶于液体的固体和液体分离的方法是过滤;②由于碳酸钠的溶解度受温度影响较大,析出晶体的方法是冷却热饱和溶液,要先蒸发浓缩、再降温析出晶体后再过滤.
故答案为:[猜想与假设]Na2CO3;[方案验证]
| 操作步骤 | 现象 | 结论 |
| (1)取该晶体加熟石灰研磨 | 无氨味 | 猜想 3和5不成立 |
| (2)另取该晶体加入盐酸 | 有气泡产生 | 猜想1不成立 |
| (3)另取少量该晶体加水溶解,再滴入氯化钙溶液 | 无白色沉淀 | 猜想4不成立 |
| (4)另取该固体放入如图试管中加热 | 包有硫酸铜的棉花变 蓝色色,石灰水变 浑浊 | 综合(1)、(2)、(3)的结论得出猜想2成立 |
点评:解答本题关键是要知道含铵根离子的盐与碱结合能产生氨气,碳酸根离子和碳酸氢根离子与酸反应能产生二氧化碳,碳酸根离子与钙离子结合产生碳酸钙沉淀;无水硫酸铜遇到水会由无色变为蓝色,二氧化碳能使澄清石灰水变浑浊.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目