题目内容
【题目】根据图示探究金属化学性质的实验,回答下列问题。
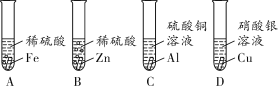
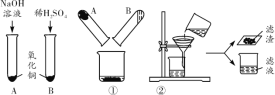
(1)有同学认为由实验A和B可以判断铁和锌的金属活动性顺序,他的依据是_____。
(2)实验C中可观察到银白色金属表面有红色物质生成,该反应的化学方程式为_____,其反应类型为_____。
(3)从实验C和D中,能得到的金属活动性强弱关系是_____(填金属的化学式)。
【答案】反应的剧烈程度(或产生气泡的速率) 2Al+3CuSO4=Al2(SO4)3+3Cu 置换反应 Al>Cu>Ag
【解析】
(1)验证不同金属的活动性顺序,可以通过探究金属能否与酸反应及反应进行的快慢、剧烈程度等进行判断。(2)银白色金属表面有红色物质产生,红色物质为金属铜,所以反应的化学方程式为2Al+3CuSO4=Al2(SO4)3+3Cu,该反应属于置换反应。(3)实验C中Al能置换出硫酸铜溶液中的Cu,说明金属活动性Al > Cu,实验D中Cu能置换出硝酸银溶液中的Ag,说明金属活动性Cu > Ag,所以由实验C、D综合可知金属活动性强弱的关系是Al > Cu >Ag。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目