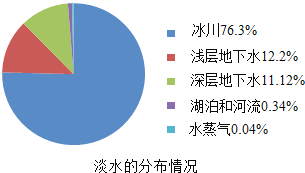
��Ŀ����
����Ŀ����ͭ��ͭп�Ͻ�ͭ����������Ϊ67%��70%����ͭ��п����Խ��Ӳ��Խ��ij��ȤС��Դ�ͭ�ͻ�ͭ��������̽����
[ʵ����]����ͭ�ͻ�ͭ
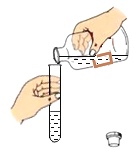
����һ������ͭƬ�ʹ�ͭƬ���
��1���۲쵽��ͭ�����п̺ۣ�˵����ͭӲ��_____����������������С��������ͭ��
���������ڴ�ͭ�ͻ�ͭ�зֱ����ϡ����
��2���۲쵽�����ݲ������ǻ�ͭ����Ӧ�Ļ�ѧ����ʽ��_____��
[ʵ����]�Ƚϻ�ͭ�봿ͭ����ʴ����
���ϣ�ͭ��ʴ��ͭ������е�O2��H2O��CO2��������Cu2��OH��2CO3����ɫ���壩��
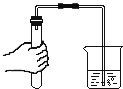
����ȤС���������ͼ����ʾ����ʵ�鷽��
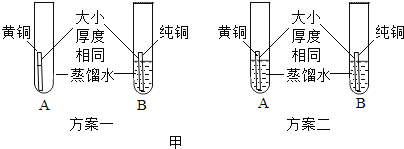
��3������һ���ڵ�������_____��
��4��С��ͬѧ������������ʵ�飬һ��ʱ�����B�Թܹ�����������ɫ��Ϊ���ԡ��ɴ˿�֪_____��������ͭ��������ͭ��������ʴ�Խ�ǿ��
[ʵ����]�ⶨ��ͭ��ͭ����������
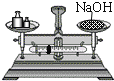
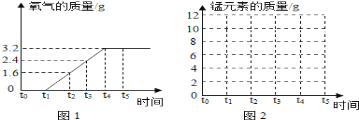
����һ��������ͼ����ʾʵ��ⶨ��ͭ��ͭ����������
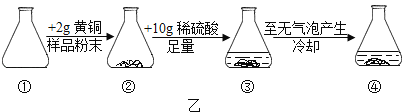
��5�����ܵ���ƿ�й������Һ����IJ���������_____�����ù��徭ϴ�ӡ��������������Ϊ1.35g��
��6�������ͭ��ͭ����������Ϊ_____��
��������������ͼ����ʾʵ��ⶨ��ͭ��ͭ����������
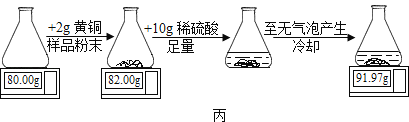
��7�����ݵ��ӳӶ������ɵû�ͭ��Ʒ��ĩ��ϡ���ᷴӦ��������_____g��
��8����������û�ͭ��ͭ��������������ƫ�ͣ�����ԭ����_____��дһ�֣���
���𰸡�С�� Zn+H2SO4�TZnSO4+H2�� û������ͬ�����½��жԱ�ʵ�飨�����������𰸣� ��ͭ ���� 67.5% 0.03 ������ˮ������������ˮ������
��������
��1����ͭ�����п̺ۣ�˵����ͭ��Ӳ�ȱȴ�ͭ��
��2��ͭ���ܺ��ᷢ����Ӧ����п��ϡ���ᷴӦ��������������п����ѧ����ʽΪ��Zn+H2SO4�TZnSO4+H2����
��3���Ƚϻ�ͭ�봿ͭ�Ŀ���ʴ���ܣ���Ҫ��ȡ���Ʊ�������������ͭ�ʹ�ͭ��֮ͬ�⣬����������������ͬ������һ�������������Ļ�����ͬ�����ȽϿ���ʴ�����Ƿ���ͬ��
��4��B�Թ���ʢ�ŵ��Ǵ�ͭ��������ɫ������˵����ͭ��ʴ���أ����ͭ�Ŀ���ʴ�Խ�ǿ��
��5��ʵ�����н������Һ�����IJ����ǹ��ˣ�
��6����ͭ��ͭ����������Ϊ![]() ��
��
��7�����ݷ�Ӧǰ�����ʵ����������䣬��������������Ϊ2g+10g+80g��91.97g��0.03g
��8����������ˮ��������������װ���⣬����װ�ü��ٵ�����ƫ�����Լ���õ�п������ƫ��ͭ����������ƫС��
�ʴ�Ϊ��
��1��С�ڣ�
��2��Zn+H2SO4�TZnSO4+H2����
��3��û������ͬ�����½��жԱ�ʵ�飨�����������𰸣���
��4����ͭ��
��5�����ˣ�
��6��67.5%��
��7��0.03��
��8��������ˮ������������ˮ��������

 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д�����Ŀ�����б��е���������Ӧ�Ļ�ѧ����ʽ��������Ӧ���Ͷ���ȷ���ǣ� ��
ѡ�� | ���� | ��ѧ��Ӧ����ʽ | ��Ӧ���� |
A | �������о������ɷ� | 2HgO | �ֽⷴӦ |
B | ̽��һ����̼�Ļ�ԭ�� | CO+CuO | �û���Ӧ |
C | �ö�����̼����̼������ | CO2+H2O�TH2CO3 | ���ͷ�Ӧ |
D | ���ú�����������ҩ������θ����� | Al��OH��3+3HCl�TAlCl3+3H2O | ���ֽⷴӦ |
����Ŀ��С����С����ʵ�����������ʯ��ʯ��Ӧ���ֱ��üס���װ��(�����Ծ�����)���ж�����̼����ȡ������ʵ�飬����δ���ֳ���ʯ��ˮ���ǣ���Դ�����ͬѧ��������Լ����뷨��
С��ͬѧʵ��ʱ����ʯ��ˮδ����ǵ�ԭ����_______��
��������⣩С��ͬѧʵ��ʱ����ʯ��ˮΪʲôû�б�����أ�
���������룩����һ������ʯ��ˮ���ʣ����������Ӧ��������������ж�����̼�⣬�����Ȼ��⣮
���������ϣ��Ȼ�����������ˮ�γ����ᣮ
��ʵ��̽����
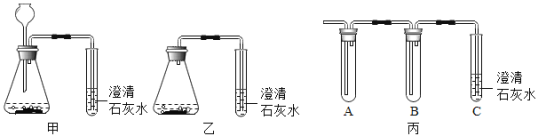
ʵ�� | ʵ�鲽�� | ʵ������ | ʵ����� |
ʵ���� | ��������CO2ͨ�뵽��ʵ�����õij���ʯ��ˮ�� | �����ʯ��ˮ���� | ����һ������ |
ʵ���� | ����Ӧ����������ͨ�뵽_____ | _____ | ��������� |
ͬѧ�Ǿ������۷��֣��ñ�װ��(��ͼ)��A��B�о�����ʵ���������Լ�����ͬʱ����������������̽��������Bװ�������������_____���������____�������������붼������
��ʵ�鷴˼����ʵ���֪��С��ͬѧʵ��ʱ���ܴ���ʹ����һ��ҩƷ����ʹ�õ�ҩƷ��___��