题目内容
【题目】苯甲酸钠(C7H5O2Na)是一种食品添加剂,广泛用于食品工业中。根据苯甲酸钠的化学式计算:
(1)一个苯甲酸钠分子由 个原子构成;
(2)苯甲酸钠中碳、氢、氧、钠元素的质量比为 (最简整数比);
(3)苯甲酸钠中质量分数最高的元素是 。(填名称);
(4)14.4g苯甲酸钠中含有钠元素的质量为 g。
【答案】(1)15;(2)84:5:32:23;(3)碳;(4)2.3
【解析】
(1)一个苯甲酸钠分子由7个碳原子5个氢原子2个氧原子1个钠原子,15个原子构成,故填:15。
(2)苯甲酸钠中碳、氢、氧、钠元素的质量比为(12×7):(1×5):(16×2):23=84:5:32:23,故填:84:5:32:23。
(3)苯甲酸钠中碳、氢、氧、钠元素的质量比为84:5:32:23,故苯甲酸钠中质量分数最高的元素是碳,故填:碳。
(4)14.4g苯甲酸钠中钠元素质量=14.4g×![]() =2.3g,故填:2.3。
=2.3g,故填:2.3。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】下表是几种物质在20℃的溶解度和相对分子质量。回答下列问题:
物质 | NaCl | NaHCO3 | NH4Cl | NH4HCO3 |
溶解度/g | 36.0 | 9.6 | 37.2 | 21.0 |
相对分子质量 | 58.5 | 84 | 53.5 | 79 |
(1)20℃时,用50g蒸馏水配制饱和NaHCO3溶液。
①计算需称量NaHCO3的质量是_____g。
②将称量的NaHCO3固体倒入盛有50g蒸馏水的烧杯中,然后用_____(填仪器名称)不断搅拌,直至_____。
③用配制所得的溶液可处理溶质的质量分数为1%的稀H2SO4_____g。
(2)相同温度下,不同溶质同时溶解在同一溶剂中,溶解度不变。在20℃时,将11.7gNaCl固体和15.8gNH4HCO3固体同时放入盛有100g水的烧杯中,充分搅拌,静置,观察到烧杯底部有晶体出现,该过程只发生复分解反应。杯底的晶体是_____,杯底晶体的质量是_____g。
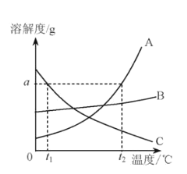
【题目】下表是KCl、KNO3、NaCl三种物质在不同温度时的溶解度,根据表格信息回答:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | KC1 | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
NaC1 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
(1)三种物质中溶解度受温度变化影响最大的是______。
(2)20℃时,50g水中加入16gKC1充分搅拌后形成_____(填“饱和”或“不饱和”)溶液。
(3)80℃时,分别将相同质量的KCl、KNO3与NaCl饱和溶液降温至20℃,析出晶体质量最大的是____。
(4)KCl与NaC1溶解度相同的温度t的范围是_____。
(5)当KNO3中混有少量的NaC1时,提纯KNO3采用的方法是____(填“蒸发结晶”或“降温结晶”)。
(6)加热时,FeCl3易与水反应生成红褐色絮状沉淀和盐酸,该反应的化学方程式为___。
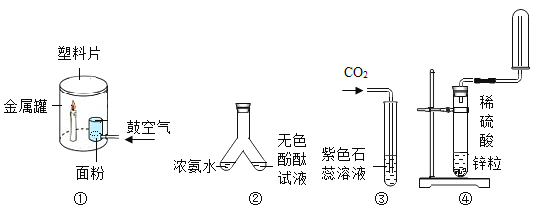
【题目】分类、类比是初种化学常用的学习方法。
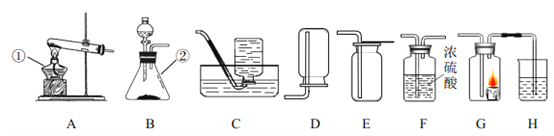
(1)下列实验都由于压强的改变而观察到一些明显的实验现象,请从引起压强改变的原理角度,将下列实验平均分成两类,则实验 __________ (填字母)分为一类,依据是__________。
|
|
|
|
A液面下导管口产生气泡 | B液面下导管口产生气泡 | C混合后气球变大 | D气球变大 |
(2)许多物质的命名与元素的化合价髙低有关系,如氯化铁、氯化亚铁,其中铁元素的化合价分别为+3价、+2价。汞元素的化合价有+2价、+ 1价两种,由此推断氧元素和+1价汞元素组成的化合物的名称是__________,其化学式为_________。