题目内容
【题目】在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应。请与他们一起完成实验方案的设计、实施和评价。
(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃)。
测定某NaOH溶液的pH,pH _____7(选填“大于”、“等于”或“小于”)。将一定量的稀H2SO4加入该NaOH溶液中,混合均匀后测定其pH ,pH 小于7。
结论:稀H2SO4与NaOH溶液发生了化学反应,并且_____过量。
(2)方案二:观察_____。(根据图示实验步骤,概括方案要点)
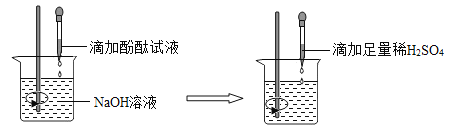
结论:稀H2SO4与NaOH溶液发生了化学反应,反应的化学方程式为_____。
(3)上述两个方案在设计思想上的相同点是_____。
(4)为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是_____(选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度_____次。
【答案】大于 稀H2SO4 滴加了酚酞的NaOH溶液颜色先变红,稀H2SO4加入后红色逐渐褪去 H2SO4+2NaOH=Na2SO4+2H2O 测定溶液反应前后的酸碱性变化来确定两种溶液混合后是否发生化学反应 放热 三
【解析】
(1)氢氧化钠溶液呈碱性,其pH大于7;硫酸呈酸性,其pH小于7,将一定量的稀硫酸加入该NaOH溶液中,混合均匀后测定其pH小于7,这说明稀硫酸与NaOH溶液发生了化学反应,并且稀硫酸过量;故填:大于;稀H2SO4;
(2)由图示可以看出,此实验为向滴有酚酞的氢氧化钠溶液中加入足量的稀硫酸,氢氧化钠显碱性,能使无色酚酞试液变红,加入稀硫酸后,氢氧化钠和硫酸反应生成硫酸钠和水,硫酸钠显中性,故加入稀硫酸后,红色逐渐褪去,故填: 滴加了酚酞的NaOH溶液颜色先变红,稀H2SO4加入后红色逐渐褪去;
氢氧化钠与稀硫酸反应生成硫酸钠和水,该反应的化学方程式为![]() ;
;
(3)无论是测溶液的pH,还是酚酞颜色的变化,都与溶液的酸碱性变化有关,故填:测定溶液反应前后的酸碱性变化来确定两种溶液混合后是否发生化学反应;
(4)中和反应为放热反应,可以通过测定反应前后溶液的温度变化来进行确定,反应前测起始温度,反应中测温度是否升高,反应完全后,加入过量的硫酸再测溶液的温度是否降低,所以测三次,故填:放热;三。

【题目】如下图所示,锥形瓶中盛有气体Ⅹ,胶头滴管中盛有液体Y。若挤压胶头滴管使液体滴入锥形瓶中,振荡一段时间后可见小气球a鼓起。下列各组中,不会出现上述现象的是( )
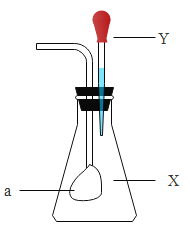
X | Y | |
A | CO2 | Ca(OH)2 |
B | CO2 | NaOH |
C | CO | Ba(OH)2 |
D | SO2 | NaOH |
A.AB.BC.CD.D