题目内容
【题目】水是由氢、氧两种元素组成的化合物。这一结论是科学家们在大量实验的基础上得出的。
(1)实验室中常用锌粒和稀硫酸反应来制备氢气。请从下列装置中选择并组装一套制取干燥氢气的装置,正确的连接顺序为__(用接口处字母填写)。
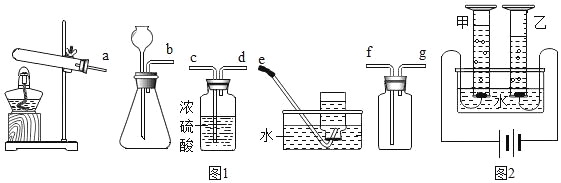
(2)研究氢气的燃烧实验是人们认识水组成的开始。
①氢气在点燃前一定要___;
②氢气在空气中燃烧时,若在火焰上方罩一冷而干燥的小烧杯,可观察到的现象是___。
(3)科学家们又用“电解法”证明了水的组成(装置如图所示,电极不与水及生成的气体反应)。电解时,水中需加入少量的NaOH,其作用是__。通电一段时间后,发现甲、乙两量筒中收集的气体体积比略小于1:2,其原因可能是__(写出一条即可)。
(4)拉瓦锡还用另一实验证明了水的组成。他让水蒸气通过一根烧红的铁质枪管,结果得到了氢气,同时枪管表面有黑色固体(磁铁矿的主要成分)生成。该反应的化学方程式为___。
【答案】bcdg 验纯 烧杯内壁有水珠产生 增强导电性 相同条件下,氧气比氢气稍易溶于水 3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
【解析】
(1)氢气是锌粒和稀硫酸反应是固体和液体混合不需要加热,浓硫酸具有吸水性,能除去氢气中的水蒸气,应将气体通入到浓硫酸中,所以连接顺序是:bcdg;
(2)①氢气具有可燃性,不纯点燃可能会发生爆炸,所以氢气在点燃前一定要验纯;
②氢气在空气中燃烧时,若在火焰上方罩一冷而干燥的小烧杯,可观察到的现象是烧杯内壁有水珠产生;
(3)电解时,水中需加入少量的NaOH,其作用是增强导电性。通电一段时间后,发现甲、乙两量筒中收集的气体体积比略小于1:2,其原因可能是相同条件下,氧气比氢气稍易溶于水;
(4)由题意可知,反应物是铁和水,生成物是四氧化三铁和氢气,反应的条件是高温,所以化学方程式为:3Fe+4H2O![]() Fe3O4+4H2。
Fe3O4+4H2。

 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】如图中“一”表示相连的物质间在一定条件下可以反应,“→”表示甲在一定条件下可转化为乙。下面四组选项中,符合如图要求的是( )
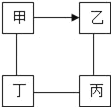
甲 | 乙 | 丙 | 丁 | |
A | H2SO4 | NaOH | NaCl | Na2CO3 |
B | CO | CO2 | H2SO4 | CuO |
C | Zn | ZnSO4 | Mg | HCl |
D | O2 | CO | CuO | C |
A. AB. BC. CD. D
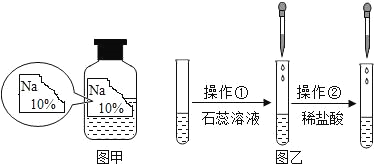
【题目】(一)某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
(猜想与假设)
其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
(资料查阅)上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下某稀溶液的pH | 7 | 13 | 11 | 9 |
(探究过程)
如图乙所示,在操作①后可确定溶质不是NaCl,则实验过程和实验现象应是_____;在进行操作②时有无色无味得到气体产生,由此又可排除假设物质中的_____。
(探究结论)
你认为该溶液中的溶质可能是上述假设物质中的_____,你的判断依据是_____。
(探究反思)
(1)若上述探究结论是正确的,操作②产生的气体应是_____(写化学式),实验室检验该气体的实验操作及现象是_____。
(2)另有同学猜想其中的溶质还可能是Na2SO4,但又没有Na2SO4的上述表列信息。
请你根据以上实验操作的相关现象,判断该溶液中的溶质是否是Na2SO4,并叙述理由:_____。
(二)兴趣小组的同学在做镁条和盐酸反应实验时发现,试管外壁很烫,试管口出现白雾。白雾是什么呢?
Ⅰ.同学们作出猜想
猜想一:是小水滴。因为盐酸溶液中的水受热会汽化上升,在试管口_____(填物态变化名称)成小水滴。
猜想二:是盐酸小液滴。因为浓盐酸具有_____性,可能实验中使用的盐酸浓度过高,试管口就会形成盐酸小液滴。
同学们将干燥的蓝色石蕊试纸放在内有正在反应的镁条和盐酸的试管口,试纸变红,证明猜想二是合理的。
Ⅱ.小柯提出质疑
为什么刚才打开盛放实验所用盐酸的试剂瓶,瓶口没有白雾,却在反应过程中出现白雾?
小柯联系反应时试管外壁很烫,于是猜想:白雾的形成可能与温度有关。
他用试管取少量盐酸,将干燥的蓝色石蕊试纸放在试管口,试纸不变红;然后_____(填操作),试纸变红。
得出结论:这种盐酸浓度并不高,是因_____促使盐酸形成白雾。