题目内容
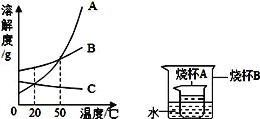
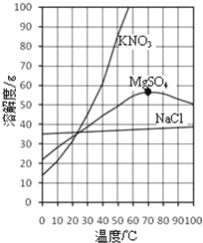
【题目】图为氯化钠、硫酸镁和硝酸钾的溶解度曲线.
(1)40℃时,向100g水中加入50g硝酸钾,所得溶液为______溶液(填“饱和”或“不饱和”),其溶质的质量分数是______.(保留一位小数)
(2)由图中获得有关硫酸镁的溶解度随温度变化的规律是______.
(3)60℃时,将氯化钠和硝酸钾分别加入100g水中各配成饱和溶液,再冷却到10℃,则装______(填“氯化钠”或“硝酸钾”)溶液的烧杯析出的晶体较多.
(4)若将50g 质量分数为20%的氯化钠溶液稀释为10%的氯化钠溶液,应加水的质量是______g.
【答案】 不饱和 33.3% 硫酸镁的溶解度在0℃﹣70℃时随温度升高而增大,而在70℃﹣100℃时随温度升高而减小 硝酸钾 50g
【解析】(1)溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。![]() ;40℃时,硝酸钾的溶解度为60g,向100g水中加入50g硝酸钾,所得溶液为不饱和,其溶质的质量分数是50g÷150g×100%≈33.3% ;(2)在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。由图中获得有关硫酸镁的溶解度随温度变化的规律是硫酸镁的溶解度在0℃﹣70℃时随温度升高而增大,而在70℃﹣100℃时随温度升高而减小。(3)60℃时,将氯化钠和硝酸钾分别加入100g水中各配成饱和溶液,再冷却到10℃,由于硝酸钾的溶解度降低幅度较大,则装硝酸钾溶液的烧杯析出的晶体较多。(4)若将50g 质量分数为20%的氯化钠溶液稀释为10%的氯化钠溶液,应加水的质量是x, 50g ×20%=(50g +x)×10%,x=50g。
;40℃时,硝酸钾的溶解度为60g,向100g水中加入50g硝酸钾,所得溶液为不饱和,其溶质的质量分数是50g÷150g×100%≈33.3% ;(2)在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。由图中获得有关硫酸镁的溶解度随温度变化的规律是硫酸镁的溶解度在0℃﹣70℃时随温度升高而增大,而在70℃﹣100℃时随温度升高而减小。(3)60℃时,将氯化钠和硝酸钾分别加入100g水中各配成饱和溶液,再冷却到10℃,由于硝酸钾的溶解度降低幅度较大,则装硝酸钾溶液的烧杯析出的晶体较多。(4)若将50g 质量分数为20%的氯化钠溶液稀释为10%的氯化钠溶液,应加水的质量是x, 50g ×20%=(50g +x)×10%,x=50g。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
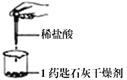
同步奥数系列答案【题目】小杰同学从家里带来一个小纸袋,上面写着“石灰干燥剂”,纸袋上信息如图,实验小组同学对该干燥剂进行如下探究。

【辨析推断】
(1)“石灰干燥剂”中的石灰是指__________(填字母)。
A.消石灰 B.生石灰 C.石灰石
(2)不可食用,幼儿勿取的原因__________。
【提出问题】该袋干燥剂的现有成份是什么呢?
【实验探究】分别取该石灰干燥剂进行如表实验,并记录。
实验目的 | 实验步骤 | 实验现象 | 实验结论 |
实验一:验证有无 CaCO3 |
| __________ | 样品中有碳酸钙 |
实验二:__________ |
| 无放热现象 | __________ |
【问题分析】同学们由上表现象结合已学知识综合分析后,认为该袋干燥剂的成份可能为:
①碳酸钙 ②碳酸钙和__________
【成分探究】取少量样品加水溶解,静置后取少量上层清液于试管中,再向试管中__________,观察到__________,证明该固体成分是两种物质。