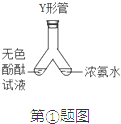
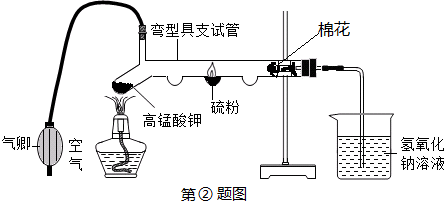
题目内容
4、对下列物质在空气或氧气中燃烧的实验现象描述正确的是( )
分析:A、石蜡在氧气中能够剧烈地燃烧,发出耀眼的白光,放出大量的热,能生成使澄清石灰水变浑浊的气体;
B、硫在氧气中能够剧烈地燃烧,发出蓝紫色火焰,放出大量的热,生成有刺激性气味的气体;
C、红磷在空气中能够剧烈地燃烧,放出大量的热,产生大量的白烟;
D、镁在空气中能够剧烈地燃烧,发出耀眼的白光,放出大量的热,能生成白色固体.
B、硫在氧气中能够剧烈地燃烧,发出蓝紫色火焰,放出大量的热,生成有刺激性气味的气体;
C、红磷在空气中能够剧烈地燃烧,放出大量的热,产生大量的白烟;
D、镁在空气中能够剧烈地燃烧,发出耀眼的白光,放出大量的热,能生成白色固体.
解答:解:A、石蜡在氧气中燃烧时,有水和二氧化碳生成属于实验结论,不属于实验现象.错误;
B、硫在氧气中燃烧时,能够生成有刺激性气味的气体.错误;
C、红磷在空气中燃烧时,生成一种白色固体.错误;
D、镁带在空气中燃烧时,发出耀眼的白光,生成白色固体.正确.
故选D.
B、硫在氧气中燃烧时,能够生成有刺激性气味的气体.错误;
C、红磷在空气中燃烧时,生成一种白色固体.错误;
D、镁带在空气中燃烧时,发出耀眼的白光,生成白色固体.正确.
故选D.
点评:本题主要考查实验现象方面的知识,解答时要注意实验现象和实验结论的区别.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目