题目内容
【题目】化学活动课上,同学们进行击鼓传花游戏,他们每个人代表一种化学物质,只要满足每关相应的要求,“花”就可以传递。已知A同学代表的是目前世界年产量最高的金属。请你利用所学的初中化学知识帮助他们通关:
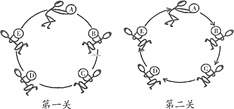
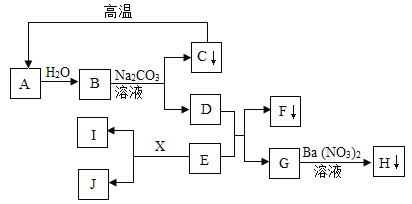
(1)第一关:要求相邻的每种物质之间可以发生反应。已知C是人胃液中的一种成分,D、E混合可以配制波尔多液。
①写出下列物质(或溶质)的化学式:A._________ B.___________
②D和E反应的化学方程式为_____________________________________________。
(2)第二关:要求相邻的每种物质之间可以发生转化(如图,箭头指向生成物)。已知B、C、D均为氧化物,E为非金属单质,且B为黑色。请回答:
①写出下列物质(或主要成分)的化学式:B.__________ C.__________
②D转化为E的现象为_______________________________。
【答案】 Fe AgNO3 Ca(OH)2 + CuSO4 ![]() Cu(OH)2↓ + CaSO4 Fe3O4 CO2 电极表面有气泡产生,一段时间后正、负极产生的气体体积比约为1:2
Cu(OH)2↓ + CaSO4 Fe3O4 CO2 电极表面有气泡产生,一段时间后正、负极产生的气体体积比约为1:2
【解析】(1)已知A同学代表的是目前世界年产量最高的金属,所以A为铁;已知C是人胃液中的一种成分,C为盐酸;B可以与A、C反应,所以B为硝酸银;D、E混合可以配制波尔多液,D、E为氢氧化钙和硫酸铜,氢氧化钙和硫酸铜反应生成氢氧化铜和硫酸钙,化学方程式为:Ca(OH)2 + CuSO4 = Cu(OH)2↓ + CaSO4;
(2)已知A同学代表的是目前世界年产量最高的金属,所以A为铁;B、C、D均为氧化物,所以B为铁的氧化物,且B为黑色,B为四氧化三铁;C可以由四氧化三铁反应生成,所以C为二氧化碳或水中一种,由于C又可以生成一种氧化物D,所以C为二氧化碳, E为非金属单质,同时可以冶炼铁,所以E为氢气,D为水。D转化为E是电解水过程,现象为电极表面有气泡产生,一段时间后正、负极产生的气体体积比约为1:2。

【题目】某同学将氢氧化钠溶液滴入到一定量的稀氯化铜溶液中,出现蓝绿色不溶于水的固体。该同学对生成蓝绿色而不是蓝色固体的现象产生疑惑。
【查阅资料】
(1)CuCl2溶液与NaOH溶液反应可生成蓝色固体【Cu(OH)2】,在氢氧化钠较少的情况下会生成蓝绿色碱式氯化铜【Cux(OH)yClz】,其不溶于水,能与酸反应。
(2)Cu(OH) 2在60℃开始分解生成两种氧化物,100℃分解完全。碱式氯化铜在300℃开始分解生成氧化铜、水和氯化氢,在400℃分解完全。
【猜测】蓝绿色固体可能是:①Cu(OH)2;②Cux(OH)yClz晶体;③___________。
猜想①的理由是:______________(用化学方程式表示)。
【实验】该同学取31.25g蓝绿色固体,加热至100℃出现黑色固体。则猜想 _______
不正确。继续加热到400℃至质量不再改变,并使产生的气体全部缓缓通过如图______(选填“甲”或“乙”)装置(装置中药品足量)。

实验数据:①最终得到剩余固体24.00g;
②与硝酸银溶液反应得到的沉淀经过滤、洗涤和低温烘干,得到固体14.35g;
③浓硫酸装置中数据如下表。
加热前 | 100℃ | 400℃ |
250.00g | 251.80g | 253.60g |
结论:猜想③成立,则碱式氯化铜中X∶Y= _______。
【延伸】
(1)碱式氯化铜常作为动物饲料的添加剂,则该碱式氯化铜与胃液发生反应的化学方程式为___________________。
(2)为使实验中生成蓝色固体,少出现蓝绿色固体,应作______改进(选填序号)。
a.实验中将氯化铜溶液滴加到氢氧化钠溶液中
b.实验中应提供足量、较浓的氢氧化钠溶液
c.实验应该在80℃的水浴中进行