题目内容
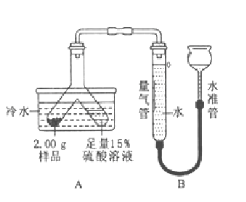
【题目】化学实验是科学探究的重要途径,请根据下列实验图示回答相关问题:
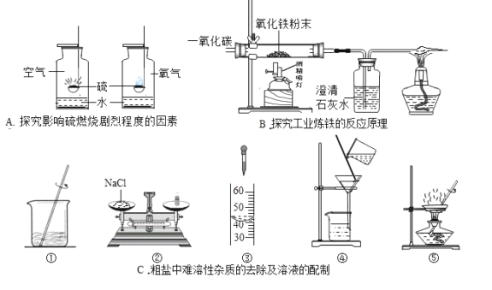
(1)A 实验中分别将硫在空气和氧气中燃烧,硫在氧气里燃烧比在空气里燃烧更剧烈,说明了硫燃烧剧烈程度和 ________相关。
(2)B 实验中,硬质玻璃管中反应的化学方程式 ________;装置末端酒精灯的作用是________.
(3)C 实验中,若要除去粗盐中难溶性的杂质,其正确操作步骤为 _________填序号), 步骤⑤中玻璃棒的作用是 ________;若按照②③①的步骤配制 50gl6%的氯化钠溶液,需要水的体积________(水的密度为 1g/mL)。若某同学所配溶液的溶质质量分数偏大,其原因可能是 ________ (填序号)。
A、称量时,砝码生锈,氯化钠质量偏大 B、氯化钠固体不纯
C、量取水时,俯视读数 D.装瓶时,有少量溶液洒出
【答案】氧气的浓度; Fe2O3+3CO ![]() 2Fe+3CO 处理尾气,防止污染空气; ②③①④⑤, 搅拌,防止因局部温度过高,造成液滴飞溅, 42mL, AC。
2Fe+3CO 处理尾气,防止污染空气; ②③①④⑤, 搅拌,防止因局部温度过高,造成液滴飞溅, 42mL, AC。
【解析】
(1)实验一中硫在氧气中燃烧比在空气中燃烧剧烈,说明影响硫燃烧剧烈程度的因素是氧气的浓度;
(2)一氧化碳和氧化铁在高温的条件下反应生成铁和二氧化碳,化学方程式为:Fe2O3+3CO ![]() 2Fe+3CO ,一氧化碳有毒,需要尾气处理,所以装置末端酒精灯的作用是:处理尾气,防止污染空气;
2Fe+3CO ,一氧化碳有毒,需要尾气处理,所以装置末端酒精灯的作用是:处理尾气,防止污染空气;
(3)粗盐提纯的步骤是:溶解、过滤、蒸发,所以正确操作步骤为:②③①④⑤,在蒸发操作中,玻璃棒的作用是:搅拌,防止因局部温度过高,造成液滴飞溅,溶剂质量=溶液质量-溶质质量,需要水的质量为:50g-50g×16%=42g,所以需要水的体积为42mL,所配溶液的溶质质量分数偏大,可能的原因是溶质质量偏多或溶剂的质量偏少。A、称量时,砝码生锈,氯化钠质量偏大,导致溶质质量分数偏大,故正确;B、氯化钠固体不纯,氯化钠的实际质量偏小,导致溶质质量分数偏小,故错误;C、量取水时,俯视读数,水的体积偏小,导致溶质质量分数偏大,故正确;D.装瓶时,有少量溶液洒出,不会影响质量分数,故错误。故选AC。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】某同学按课本要求做CuSO4溶液与NaOH溶液反应的实验,有蓝色沉淀生成,对该沉淀进行加热,一般看到蓝色沉淀变黑色,可有时却看到蓝色沉淀变绿色。该同学对着异常现象产生了兴趣,决定对这现象产生的实验条件进行探究。
(查阅资料)难溶性碱受热易分解成对应的金属氧化物
写出上述生成蓝色沉淀以及蓝色沉淀变黑色的化学反应方程式:___________、__________。
(提出问题)加热蓝色沉淀没有出现黑色固体与什么因素有关?
(作出猜想)1.与CuSO4溶液过量有关;2.与NaOH溶液过量有关
(设计实验)限选试剂:1%的NaOH溶液,20%NaOH溶液,20%CuSO4溶液,1%CuSO4溶液
实验方案 | 实验现象 | 实验结论 |
1.往2mL20%CuSO4溶液中滴加2滴1%NaOH溶液,再将所得沉淀加热。 | 先产生蓝色沉淀,加热后 ______。 | 猜想1不成立 |
2._____,再将所得沉淀加热。 | 先产生蓝色沉淀,加热后 _______。 | 猜想2成立 |
(得到结论)在上述实验中,要能观察到蓝色沉淀变黑色,关键是___________
(拓展与反思)进一步查阅资料可知上述绿色物质是溶解度与氢氧化铜更小的水胆矾[化学式为Cu4(OH)6SO4],在碱性较强的条件下容易形成,继续加热一段时间该绿色固体则可产生黑色沉淀,写出该反应方程式__________.
【题目】空气中氧气含量测定的再认识。
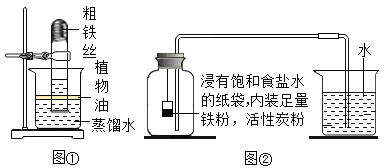
(实验回顾)实验室常用红磷燃烧的方法测定空气中氧气的含量。在老师的指导下,小明分别用过量的红磷和白磷进行该实验,用测氧气浓度的传感器测得反应后装置内氧气浓度分别为8.85%和3.21%。请从燃烧条件的角度回答产生上述结果的主要原因:__________________________________________。
(实验探究1)小明根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量。于是进行了实验(装置如图①)。通过7天测得的数据计算出空气中氧气的含量为19.13%。
(交流与反思)与用红磷燃烧的方法相比,用铁丝生锈的方法测定的主要优点是____________________________.
(实验探究2)为了加快反应速率,小明通过查阅资料,林勇铁粉、碳粉、氯化钠等物质又进行了实验(装置如图②)。8分钟后测得的数据如下表:
测量项目 | 实验前 | 实验后 | |
集气瓶(扣除内容物)和导管的容积 | 烧杯中的水的体积 | 烧杯中剩余水的体积 | |
体积/mL | 126.0 | 80.0 | 54.5 |
请计算出空气中氧气含量________________(计算结果保留一位小数)。
(结论与反思)通过上述实验探究,选择______________(填物质名称)进行实验可较为快速地完成实验并减小实验误差。
(拓展延伸)铜也能与空气中氧气、水、二氧化碳反应二锈蚀,生成铜绿(铜绿主要成分为![]() )。若将图①装置中的粗铁丝换成足量的铜丝进行实验,请判断能否比较准确地测定空气中氧气的含量______________,并说明理由_________________________。
)。若将图①装置中的粗铁丝换成足量的铜丝进行实验,请判断能否比较准确地测定空气中氧气的含量______________,并说明理由_________________________。