题目内容
【题目】某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了右图实验,对固体B的成分进行了分析和实验探究. 【提出问题】固体B中的成分可能有哪些?
(1)【作出猜想】甲同学:只有Ag 乙同学:Zn、Ag
丙同学:Cu、Ag
请写出你的一种猜想
(2)【表达交流】写出甲同学猜想的理由
(3)【反思评价】请你评价乙同学的猜想
(4)【实验探究】想证明自己的猜想正确
实验步骤 | 现象 | 由此确定固体B的成分写出反应的化学方程式 |
取少量固体B,滴加 | 有气泡产生 |
在得出固体B的成分后,也确定了液体A的成分,液体A中含有的物质有(化学式)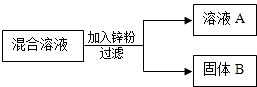
【答案】
(1)Ag、Cu、Zn
(2)当锌恰好与AgNO3反应时,溶液中的溶质是:Zn(NO3)2、Cu(NO3)2或当AgNO3有剩余时,溶液中的溶质是:Zn(NO3)2、AgNO3、Cu(NO3)2 , 固体为:只有Ag
(3)不合理,Zn应先与AgNO3反应后与Cu(NO3)2反应
(4)稀盐酸;Zn+2HCl=ZnCl2+H2↑;Zn(NO3)2
【解析】解:由金属活动性顺序及其运用可知,向AgNO3和Cu(NO3)2混合溶液中加入锌粉,Zn应先与AgNO3反应后与Cu(NO3)2反应.由于锌粉量的不同,溶液A中的溶质不同.当锌的量过量时,溶液中的溶质只有Zn(NO3)2 , 固体为:Ag、Cu、Zn;当锌的量过量时,溶液中的溶质只有Zn(NO3)2或当AgNO3有剩余时,溶液中的溶质是:Zn(NO3)2、AgNO3、Cu(NO3)2 , 固体为:只有Ag; 由以上分析可知:
[交流讨论]甲同学猜想的理由:当锌的量过量时,溶液中的溶质只有Zn(NO3)2或当AgNO3有剩余时,溶液中的溶质是:Zn(NO3)2、AgNO3、Cu(NO3)2 , 固体为:只有Ag;
[反思评价]乙同学的猜想不合理;理由是:Zn应先与AgNO3反应后与Cu(NO3)2反应;
[实验探究]当锌粉过量时,溶液中的溶质只有Zn(NO3)2 , 固体B中有锌,当加入酸时有气泡生成,故下表为:
实验步骤 | 现象 | 有关反应的化学方程式 |
稀盐酸(或稀硫酸等) | 有气泡产生 | Zn+2HCl=ZnCl2+H2↑ |
由于锌的量过量,溶液中的溶质只有Zn(NO3)2 ,
故答为:[作出猜想]Ag、Cu、Zn
[表达交流]当锌恰好与AgNO3反应时,溶液中的溶质是:Zn(NO3)2、Cu(NO3)2或当AgNO3有剩余时,溶液中的溶质是:Zn(NO3)2、AgNO3、Cu(NO3)2 , 固体为:只有Ag;
当有AgNO3剩余时,溶质中一定含有Zn(NO3)2、AgNO3、Cu(NO3)2;
[反思评价]不合理,Zn应先与AgNO3反应后与Cu(NO3)2反应;
[实验探究]见上表,Zn(NO3)2 .
【考点精析】根据题目的已知条件,利用金属材料的选择依据和书写化学方程式、文字表达式、电离方程式的相关知识可以得到问题的答案,需要掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;注意:a、配平 b、条件 c、箭号.

 名校课堂系列答案
名校课堂系列答案