题目内容
小强去商店买回一包纯碱,包装说明如右图.为测定该纯碱中碳酸钠含量是否符合标签要求,他称取了纯碱样品11g,全部溶解在50g水中,当加入稀盐酸64.4g时,恰好完全反应,所得溶液的质量为121g.试求:
(1)反应放出的CO2的质量为 g。
(2)纯碱样品中碳酸钠的质量。
(3)根据这一次检测,计算并判断样品中碳酸钠的含量是否符合标签要求。

(1)4.4g (2)10.6g (3)不符合标签要求。
【解析】
试题分析:(1)根据质量守恒定律可以求算出生成的二氧化碳的质量;
(2)根据二氧化碳的质量结合化学方程式可以求算出碳酸钠的质量,根据质量分数的计算公式计算出碳酸钠的质量;
(3)根据(2)碳酸钠的质量即可求出碳酸钠的质量分数后与包装说明相比较即可完成解答。
解:(1)根据质量守恒定律可以知道生成二氧化碳的质量为:11g+50g+64.4g﹣121g=4.4g;
(2)设纯碱样品中碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
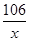 =
=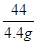
解得:x=10.6g
(3)纯碱样品中碳酸钠的质量分数为: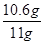 ×100%=96.4%
×100%=96.4%
因为96.4%<98%,所以该纯碱样品中碳酸钠的质量分数不符合标签要求。
答:(2)纯碱样品中碳酸钠的质量为10.6g;
(3)该纯碱样品中碳酸钠的质量分数不符合标签要求。
考点:考查根据化学反应方程式的计算

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案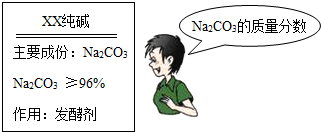
回到学校,他取出从家里带来的一小包纯碱样品和小明一起进行实验,小明和小强分别设计了以下两种不同的实验方案:
| 实验方案 | |
| 小强 | 准确称取5.5g纯碱样品放入烧杯中,又取来50克、14.6%的稀盐酸逐滴加入,至刚好不再产生气泡停止滴加稀盐酸,还剩余稀盐酸25克. |
| 小明 | 准确称取5.5g纯碱样品放入锥形瓶中,加入一定质量分数、足量的稀盐酸,并将产生的气体干燥后通入足量的氢氧化钠溶液中(如图所示),充分吸收后,称量氢氧化钠溶液质量增加了2.0克.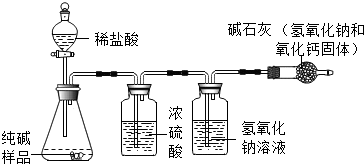 |
(2)小明测得的纯碱样品中碳酸钠的质量分数是多少?(写出计算过程)
(3)两位同学又请来老师帮忙,老师选取另外一种测定方法经反复测定结果都是96.3%,请你结合实验过程分析一下两位同学谁的测定结果不准确,为什么?
(3分) 星期天,小强的妈妈要焙制面包,叫小强去商店买回一包纯碱,小强仔细看了包装说明(如下图),并产生疑问:纯碱样品中碳酸钠的质量分数是否达标呢?
回到学校,他取出从家里带来的一小包纯碱样品和小明一起进行实验,小明和小强分别设计了以下两种不同的实验方案:
| | 实验方案 |
| 小强 | 准确称取5.5 g纯碱样品放入烧杯中,又取来50克、14.6%的稀盐酸逐滴加入,至刚好不再产生气泡停止滴加稀盐酸,还剩余稀盐酸25克。 |
| 小明 | 准确称取5.5 g纯碱样品放入锥形瓶中,加入一定质量分数、足量的稀盐酸,并将产生的气体干燥后通入足量的氢氧化钠溶液中(如下图所示) ,充分吸收后,称量氢氧化钠溶液质量增加了2.0克。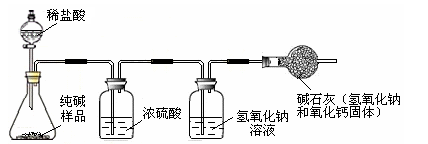 |
(2)小明测得的纯碱样品中碳酸钠的质量分数是多少?(写出计算过程)
(3)两位同学又请来老师帮忙,老师选取另外一种测定方法经反复测定结果都是96.3%,请你结合实验过程分析一下两位同学谁的测定结果不准确,为什么?

回到学校,他取出从家里带来的一小包纯碱样品和小明一起进行实验,小明和小强分别设计了以下两种不同的实验方案:
| 实验方案 | |
| 小强 | 准确称取5.5g纯碱样品放入烧杯中,又取来50克、14.6%的稀盐酸逐滴加入,至刚好不再产生气泡停止滴加稀盐酸,还剩余稀盐酸25克. |
| 小明 | 准确称取5.5g纯碱样品放入锥形瓶中,加入一定质量分数、足量的稀盐酸,并将产生的气体干燥后通入足量的氢氧化钠溶液中(如图所示),充分吸收后,称量氢氧化钠溶液质量增加了2.0克. |
(2)小明测得的纯碱样品中碳酸钠的质量分数是多少?(写出计算过程)
(3)两位同学又请来老师帮忙,老师选取另外一种测定方法经反复测定结果都是96.3%,请你结合实验过程分析一下两位同学谁的测定结果不准确,为什么?
 小强去商店买回一包纯碱,包装说明如右图.为测定该纯碱中碳酸钠含量是否符合标签要求,他称取了纯碱样品11g,全部溶解在50g水中,当加入稀盐酸64.4g时,恰好完全反应,所得溶液的质量为121g.试求:
小强去商店买回一包纯碱,包装说明如右图.为测定该纯碱中碳酸钠含量是否符合标签要求,他称取了纯碱样品11g,全部溶解在50g水中,当加入稀盐酸64.4g时,恰好完全反应,所得溶液的质量为121g.试求: