题目内容
请根据下图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题: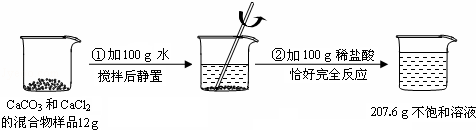
(1)实验所用稀盐酸的溶质的质量分数为 .
(2)计算原混合物样品中CaCl2的质量(写出计算过程).
7.3%;2g.
解析试题分析:(1)反应中生成CO2的质量为:12g+100g+100g﹣207.6g=4.4g,设盐酸的质量分数为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
100g?y 4.4g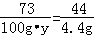
解得:y=7.3%;
(2)设原混合物中 CaCO3的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g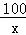 =
=
解得:x=10g
所以原混合物样品中CaCl2的质量为:12g﹣10g=2g
答:原混合物样品中CaCl2的质量为2g.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
| NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 398 |
①以上两种物质溶解度的变化受温度影响较小的是 .
②30℃时,KNO3的溶解度是 g/100g水.
③KNO3溶液中含有少量NaCl时,可通过 的方法提纯.
④对③析出的晶体剩余溶液描述正确的是 (填写编号).
I、剩余溶液一定是KNO3饱和溶液 II、剩余溶液一定是NaCl不饱和溶液
III、上述方法可以将两者完全分开 IV、析出的晶体中只含有KNO3
凯氏定氮法中用硼酸(H3BO3)等试剂进行蛋白质含氮量测定,硼酸中硼元素的化合价是
| A.+1 | B.+2 | C.+3 | D.+6 |
纯净物X在氧气中完全燃烧的化学方程式为:X+2O2 CO2+2H2O,下列说法不正确的是( )
CO2+2H2O,下列说法不正确的是( )
| A.该反应前后原子的种类发生改变 | B.X的化学式为CH4 |
| C.该反应的生成物都是氧化物 | D.X是天然气的主要成分 |
一氯胺(NH2Cl)是国家新版(生活饮用水卫生标准)中新增的一种消毒剂,下列关于一氯胺的说法中正确的是( )
| A.一氯胺是有机化合物 | B.一氯胺相对分子质量为51.5g |
| C.一氯胺由三种元素组成 | D.一氯胺中氮元素的质量分数最高 |
下列有关NH4NO3的计算结果错误的是
| A.NH4NO3的相对分子质量为80 | B.NH4NO3中原子个数比N︰H︰O = 2︰4︰3 |
| C.NH4NO3中氮元素的质量分数为35% | D.NH4NO3中元素质量比N︰H︰O = 14︰1︰6 |