题目内容
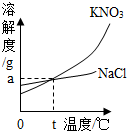
下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
| NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 398 |
①以上两种物质溶解度的变化受温度影响较小的是 .
②30℃时,KNO3的溶解度是 g/100g水.
③KNO3溶液中含有少量NaCl时,可通过 的方法提纯.
④对③析出的晶体剩余溶液描述正确的是 (填写编号).
I、剩余溶液一定是KNO3饱和溶液 II、剩余溶液一定是NaCl不饱和溶液
III、上述方法可以将两者完全分开 IV、析出的晶体中只含有KNO3
①NaCl;
②45.8;
③冷却热饱和溶液(或降温结晶);
④Ⅰ.
解析试题分析:①从图表中可知,硝酸钾的溶解度变化受温度影响较大,氯化钠的溶解度变化受温度影响较小;
②从图中可知30℃时KNO3的溶解度45.8g;
③从图中可知硝酸钾的溶解度受温度变化影响较大,而氯化钠的溶解度受温度变化影响较小,所以若KNO3溶液中含有少量NaCl时,可通过降温结晶(或冷却热饱和溶液)的方法提纯KNO3;
④Ⅰ、饱和溶液是指在一定温度下,不能再溶解这种溶质的溶液,既然有硝酸钾晶体析出,剩余的溶液一定是硝酸钾的饱和溶液,故Ⅰ正确;
Ⅱ、由于不知道温度和氯化钠的含量,所以不能判断剩余溶液是否是氯化钠的饱和溶液,故Ⅱ错误;
Ⅲ、低温下硝酸钾依然能够溶解,所以该方法不能将两者完全分开,故Ⅲ错误;
Ⅳ、硝酸钾和氯化钠的溶解度在一定温度下有相等的时候,所以在硝酸钾晶体中可能混有氯化钠,故Ⅳ错误.
故选Ⅰ
考点:固体溶解度的影响因素;结晶的原理、方法及其应用.
点评:此题是对固体溶解度知识的考查,解题时借助图表的信息对题目的要求进行分析探讨即可,熟记常见物质的溶解度受温度的影响.

练习册系列答案
相关题目
某金属氯化物溶液200g,溶质质量分数为5.55%,向其中滴加硝酸银溶液至不再产生沉淀为止,过滤,干燥得到固体28.7g,则该金属氯化物的化学式为( )
| A.NaCl | B.MgCl2 | C.CaCl2 | D.FeCl3 |
NaNO2中氮元素的化合价是
| A.+5 | B.+3 | C.+1 | D.-3 |