题目内容
 为确定某硫酸铜粉末中是否混有硫酸钠,该实验小组同学先用托盘天平称取50g该粉末,溶于水配成219.6g溶液,再往其中加入溶质质量分数为8%的NaOH溶液,发生如下反应:
为确定某硫酸铜粉末中是否混有硫酸钠,该实验小组同学先用托盘天平称取50g该粉末,溶于水配成219.6g溶液,再往其中加入溶质质量分数为8%的NaOH溶液,发生如下反应:CuSO4+2NaOH═Na2SO4+Cu(OH)2↓
产生沉淀的质量与所加NaOH溶液质量的关系如图所示.据图回答:(结果保留小数点后一位)
(1)计算产生最大沉淀量时所加NaOH溶液的质量.
(2)通过计算确定50g固体粉末的组成(回答出物质中有无硫酸钠,若有,计算其质量)
(3)计算A点所示溶液中溶质的质量分数.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)根据氢氧化铜沉淀的质量求出所加NaOH溶液的质量、参加反应的硫酸铜的质量以及生成硫酸钠的质量进行解答;
(2)根据硫酸铜的质量确定是否含有硫酸钠进行解答;
(3)根据溶质质量分数公式求出A点所示溶液中溶质的质量分数即可.
(2)根据硫酸铜的质量确定是否含有硫酸钠进行解答;
(3)根据溶质质量分数公式求出A点所示溶液中溶质的质量分数即可.
解答:解:(1)设生成最大沉淀量时所加NaOH的质量为x,50g粉末中含有CuSO4的质量为y,生成Na2SO4的质量为z.
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
160 80 142 98
y x z 19.6g
=
x=16.0g
=
y=32.0g
=
z=28.4g
那么NaOH溶液的质量=
=200.0g
(2)Na2SO4的质量=50g-32g=18g
则50g固体粉末由18g Na2SO4和32.0g CuSO4组成.
(5)Na2SO4的质量分数=
×100%=11.6%
答:(1)生成最大沉淀量时所加NaOH溶液的质量为200g;
(2)固体粉末由18g Na2SO4和32.0g CuSO4组成;
(3)A点所示溶液中溶质的质量分数11.6%.
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
160 80 142 98
y x z 19.6g
| 80 |
| x |
| 98 |
| 19.6g |
x=16.0g
| 160 |
| y |
| 98 |
| 19.6g |
y=32.0g
| 142 |
| z |
| 98 |
| 19.6g |
z=28.4g
那么NaOH溶液的质量=
| 16g |
| 8% |
(2)Na2SO4的质量=50g-32g=18g
则50g固体粉末由18g Na2SO4和32.0g CuSO4组成.
(5)Na2SO4的质量分数=
| 28.4g+18g |
| 219.6g+200g-19.6g |
答:(1)生成最大沉淀量时所加NaOH溶液的质量为200g;
(2)固体粉末由18g Na2SO4和32.0g CuSO4组成;
(3)A点所示溶液中溶质的质量分数11.6%.
点评:本题考查了化学方程式的计算和溶液中溶质的质量分数相结合的计算能力,对学生问题分析能力要求较高.

练习册系列答案
相关题目

 (1)用化学符号表示:
(1)用化学符号表示: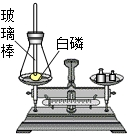 如图是测定白磷燃烧前后质量的变化情况,用来检验质量守恒的实验,试回答:
如图是测定白磷燃烧前后质量的变化情况,用来检验质量守恒的实验,试回答: