题目内容
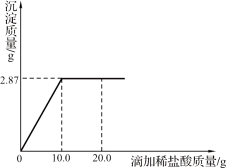
【题目】(7分)请根据下图所示的实验过程和提供的数据计算:
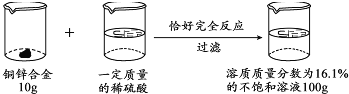
(1)(2分)最终生成的不饱和溶液中溶质的质量为 。
(2)(2分)合金中铜的质量分数 ;
(3)(2分)求所加稀硫酸的溶质质量分数。
(4)(1)配制本实验需要的稀硫酸,大斌选用的是98%的浓硫酸,请问在配制过程中需要另外加水多少克?
【答案】(1)16.1g (2)35% (3)10.5% (4)83.7g
【解析】
试题分析:(1)根据溶质质量分数计算公式进行计算,100g×16.1%=16.1g (2)根据溶质质量,利用化学方程式进行计算即可。(3)利用化学方程式进行计算。 具体如下:
解:设所加稀硫酸的溶质质量为x,合金中锌的质量为Y
Zn+H2SO4=ZnSO4+H2↑
65 98 161
Y x 16.1g
![]() x=9.8g 65/161=Y/16.1g Y=6.5g
x=9.8g 65/161=Y/16.1g Y=6.5g
则合金中铜的质量分数=(10g-6.5g)/10g×100%=35%
稀硫酸的溶质质量分数为:![]()
(4)根据溶液稀释前后,溶质质量保持不变进行计算即可。具体如下:
解:设所需的98%的浓硫酸的质量为y,
98%y=9.8 y=10g
所配制的稀硫酸溶液的质量为:100g-16.1g+9.8g=93.7g
所需加的水的质量:![]() =93.7g-10g=83.7g
=93.7g-10g=83.7g
答:略

练习册系列答案
相关题目