题目内容
50 g镁、锌、铁的混合物与足量的稀硫酸反应,将混合溶液蒸干后可得不含结晶水的固体146 g,则反应生成氢气的质量为
A. 1 g B. 2 g C. 3 g D. 4 g
B
【解析】
试题分析:三种金属与硫酸反应的结果是:Mg→MgSO4; Zn→ZnSO4; Fe→FeSO4。这个变化中,最终所得的固体的质量,比混合金属增加的质量,就是硫酸根的质量:146g-50g=96g,而氢气的质量都来自于反应掉的硫酸中氢元素的质量,在H2SO4中氢元素与硫酸根的质量比为2:96;设该硫酸中硫酸根的质量为x,则有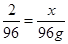 ;x=2g;选B。
;x=2g;选B。
考点:物质的组成;化学反应的本质。
点评:解答本题,要充分分析化学反应的过程和本质,知道最终所得固体增加的质量是金属与硫酸根质量的总和,然后还要想到,硫酸中的氢元素与硫酸根的质量比为2:96才行,难度较大。

某校化学研究性学习小组探究气体制取的实验原理与方法。
(1)甲同学将课本的基础知识进行整理如下图,请你帮助他完成相关内容。

制取气体 | 所需药品 | 装置连接顺序 | 反应的化学方程式 |
氧气 | 氯酸钾和二氧化锰 | ||
二氧化碳(干燥) | 大理石和稀盐酸 |
(2)乙同学设计的实验装置(如右图),既可用于制取
气体,又可用于验证物质性质。当打开K1、关闭
K2时,利用I、Ⅱ装置可直接进行的实验是
(填序号)。
①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
(3)丙同学认为在不改变I、Ⅱ、Ⅲ装置的仪器及
位置的前提下,该装置可用于过氧化钠 (Na2O2)与水反应制取氧气,另一产物为氢氧化钠,则该反应的化学方程式为: ;她的改进措施是 。
(4)丁同学打开K2、关闭K1,利用I、Ⅲ装置来验证生成的二氧化碳中含有水蒸气,此时C中盛放的物质是 ,可以观察到的现象是 .
(5)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应)作如下回收处理:
①通过以下四步实验操作回收二氧化锰。正确操作的先后顺序是 (填写选项序号)。
a.烘干 b.溶解 c.过滤 d.洗涤
②用所得氯化钾晶体配制50 g质量分数为5%的氯化钾溶液,需要氯化钾的质量为 。
③过滤、蒸发时都需用到的仪器是 (填序号)。
A.酒精灯 B.烧杯 C.玻璃棒 D.漏斗 E.量筒
(6)小明用6.5 g可能含有铜、铝、铁、镁中的一种或几种金属杂质的锌粉,跟足量的稀盐酸完全反应时,生成0.2 g氢气,则此锌粉中一定含有的金属杂质是 .

50 g镁、锌、铁的混合物与足量的稀硫酸反应,将混合溶液蒸干后可得不含结晶水的固体146 g,则反应生成氢气的质量为
| A.1 g | B.2 g | C.3 g | D.4 g |
50 g镁、锌、铁的混合物与足量的稀硫酸反应,将混合溶液蒸干后可得不含结晶水的固体146 g,则反应生成氢气的质量为
| A.1 g | B.2 g | C.3 g | D.4 g |