题目内容
【题目】某化学实验小组欲测定一种大理石中碳酸钙的纯度,进行了如图所示实验。请回答下列问题:
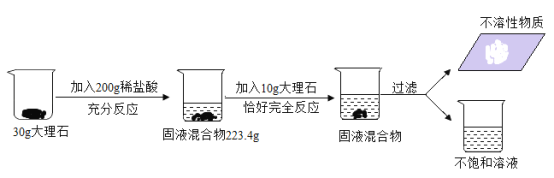
(1)请写出发生反应的化学方程式_____;
(2)请根据已知条件列出求解第一次参加反应的碳酸钙质量(x)的比例式为_____;
(3)此大理石中碳酸钙的纯度为_____;
(4)用36.5%的浓盐酸配制上述实验中所用稀盐酸,需加水的质量为_____;
(5)若将所得滤液蒸发11.2g水,则所得不饱和溶液的溶质质量分数为_____。
【答案】![]()
![]() 50% 160g 11.1%
50% 160g 11.1%
【解析】
碳酸钙和稀盐酸生成氯化钙、水和二氧化碳,由质量守恒定律可知,反应物的总质量等于生成物的总质量,减少的是生成的气体或沉淀的质量。
(1)碳酸钙和稀盐酸生成氯化钙、水和二氧化碳,故发生反应的化学方程式为![]() 。
。
(2)由质量守恒定律可知,反应物的总质量等于生成物的总质量,减少的是生成的气体或沉淀的质量,则第一次参加反应生成的二氧化碳的质量为![]()
设第一次参加反应的碳酸钙质量为x
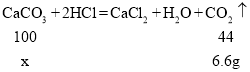
![]()
故第一次参加反应的碳酸钙质量(x)的比例式为![]() 。
。
(3)第一次参加反应的碳酸钙质量为![]() ,故大理石中碳酸钙的纯度为
,故大理石中碳酸钙的纯度为![]() 。
。
(4)设参加反应的氯化氢的质量为y
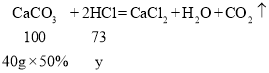
![]()
![]()
稀释前后溶质质量不变,则需加水的质量为:![]() 。
。
(5)设完全反应生成的氯化钙的质量为z,生成二氧化碳的质量为m
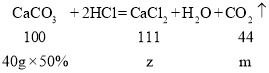
![]()
![]()
若将所得滤液蒸发11.2g水,则所得不饱和溶液的溶质质量分数为![]() 。
。

【题目】下列对客观事实书写的化学方程式及其反应类型都正确的是( )
选项 | 客观事实 | 化学方程式 | 基本反应类型 |
A | 铁丝在氧气中燃烧 | 2Fe+3O2 | 化合反应 |
B | 加热高锰酸钾 | 2KMnO4 | 分解反应 |
C | 乙醇燃烧 | C2H5OH+3O2 | 氧化反应 |
D | 硫酸钾溶液和氯化钡溶液反应 | K2SO4+BaCl2=2KCl +BaSO4 | 复分解反应 |
A.AB.BC.CD.D
【题目】为了测定液化气中丙烷(C3H8)在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
物质 | 丙烷 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 4.4 | 12.8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | a |
下列判断正确的是
A.表中a的值为5.6 B.X可能是该反应的催化剂
C.X可能含有氢元素 D.X只含碳元素