题目内容
【题目】为了测定液化气中丙烷(C3H8)在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
物质 | 丙烷 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 4.4 | 12.8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | a |
下列判断正确的是
A.表中a的值为5.6 B.X可能是该反应的催化剂
C.X可能含有氢元素 D.X只含碳元素
【答案】A
【解析】
试题分析:A反应前物质的总质量为4.4g+12.8g=17.2g;反应后物质的总质量为7.2g+4.4g+ag。根据反应前后,物质的总质量不变且容器为密闭容器可知:7.2g+4.4g+ag=17.2g。则a=5.6 此项正确。B物质X在反应前的质量为零,反应后的质量为5.6g;应为生成物。此项不正确。C根据质量守恒定律可知:反应前后元素的质量不变。反应前氢元素的质量即丙烷中氢元素的质量为:4.4g ×(![]() ×100%)=0.8g;反应后水中氢元素的质量为:7.2g×(
×100%)=0.8g;反应后水中氢元素的质量为:7.2g×(![]() ×100%)=0.8 g;二者相等,所以X中没有氢元素。此项不正确。D根据质量守恒定律可知:反应前后元素的质量不变。反应前碳元素的质量即丙烷中碳元素的质量为:4.4g ×(
×100%)=0.8 g;二者相等,所以X中没有氢元素。此项不正确。D根据质量守恒定律可知:反应前后元素的质量不变。反应前碳元素的质量即丙烷中碳元素的质量为:4.4g ×(![]() ×100%)=3.6g;反应后水二氧化碳中碳元素的质量为:4.4g×(
×100%)=3.6g;反应后水二氧化碳中碳元素的质量为:4.4g×(![]() ×100%)=1.2 g;所以X中含碳元素的质量为3.6g—1.2 g=2.4 g<5.6g。因此X中不可能只含碳元素。此项不正确。
×100%)=1.2 g;所以X中含碳元素的质量为3.6g—1.2 g=2.4 g<5.6g。因此X中不可能只含碳元素。此项不正确。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案【题目】(5分)KNO3和NaCl在不同温度时的溶解度如下表所示。请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |||||||||
溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | ||||||||
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | |||||||||
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图所示:
图中能表示KNO3溶解度曲线的是 (填“A”或“B”)
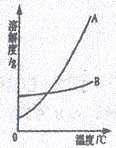
(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解 度,则温度的范围是 ;
(3)某兴趣小组做了一下实验:
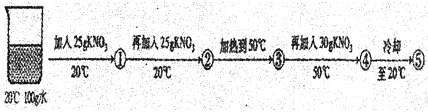
上述实验过程中得到的溶液一定属于不饱和溶液的是 (填数字序号),将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体 g;
(4)硝酸钾中含有少量氯化钠时,可通过 (填“蒸发结晶”或“降温结晶”)的方法提纯。