题目内容
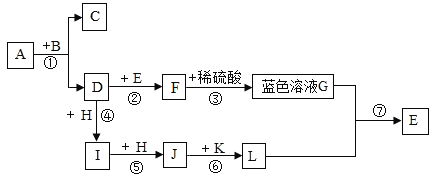
【题目】镁及其合金是用途很广的金属材料,目前世界是60%的的镁是从海水中提取的,主要骤如下:
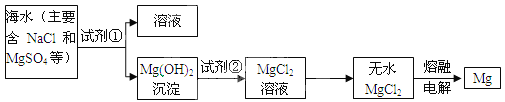
(1)![]() 的物质类别为_____(填“酸”、“碱”或“盐”);若试剂①为烧碱溶液,则生成
的物质类别为_____(填“酸”、“碱”或“盐”);若试剂①为烧碱溶液,则生成![]() 的化学方程式为_____。
的化学方程式为_____。
(2)加人试剂①后,能够分离得到![]() 沉淀的方法_____,是在实验室要完成这种操作,需要的玻璃仪器除了烧杯、漏斗外,还必须使用的一种仪器是_____,该仪器在溶解固体的操作中,作用是_____。
沉淀的方法_____,是在实验室要完成这种操作,需要的玻璃仪器除了烧杯、漏斗外,还必须使用的一种仪器是_____,该仪器在溶解固体的操作中,作用是_____。
(3)已知蒸发![]() 溶液的过程中,
溶液的过程中, ![]() 会与水反应生成
会与水反应生成![]() 和一种气体物质,该气体溶于水得到的溶液的名称为_____。
和一种气体物质,该气体溶于水得到的溶液的名称为_____。
【答案】碱 ![]() 过滤 玻璃棒 搅拌,加速溶解 盐酸
过滤 玻璃棒 搅拌,加速溶解 盐酸
【解析】
(1)氢氧化镁在电离时产生的阴离子全部是氢氧根离子,所以属于碱;氢氧化钠与硫酸镁发生复分解反应生成硫酸钠和氢氧化镁白色沉淀,反应的化学方程式为:![]() ;
;
(2)将难溶性固体与液体进行分离应采用过滤操作。过滤操作需要的玻璃仪器有烧杯、漏斗和玻璃棒,在溶解固体的操作中,玻璃棒的作用是搅拌、加速溶解;
(3)已知蒸发MgCl2溶液的过程中,MgCl2会与水反应生成Mg(OH)2和一种气体物质,由质量守恒定律可知该气体是氯化氢气体,氯化氢气体溶于水形成盐酸。

 字词句段篇系列答案
字词句段篇系列答案【题目】要除去下列各物质中的少量杂质,所选试剂和方法均正确的是( )
选项 | 物质(括号内为杂质) | 试剂及主要实验操作 |
A |
| 通过装有足量 |
B |
| 加热 |
C |
| 加入足量的铁粉,充分反应后过滤 |
D |
| 加适量 |
A.AB.BC.CD.D
【题目】请从A或B两题中任选1个作答,若两题均作答,按A计分。
A | B |
火力发电厂常用石灰石浆吸收废气中的二氧化硫,以防止空气污染。反应化学方程式为: 2CaCO3+O2+2SO2===2CaSO4+2CO2若处理含有1.6 kg二氧化硫的废气,至少需要碳酸钙的质量为________ kg才能将其完全吸收。 | 原煤中含有硫,燃烧时生成的SO2会污染空气。测量SO2含量的化学方程式为:SO2+2H2O+I2=== H2SO4+2HI,取用原煤燃烧产生的工业废气样品1 m3,缓缓通过含碘(I2)1.27 mg的碘溶液,刚好完全反应。则该工业废气中SO2的含量为____mg/m3(假设工业废气中的其它物质不与碘反应)。 |