题目内容
Ⅰ.探究:实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小强和小华同学很感兴趣,决定对其成分进行探究.
提出问题:这瓶试剂可能是什么溶液呢?
交流讨论:根据受损标签的情况判断,这瓶试剂不可能是______
A.酸 B.碱 C.盐
查阅资料:①初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3.
②Na2CO3和NaHCO3溶液都呈碱性.
③测定室温(20℃)时,四种物质的溶解度的数据如下:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
设计实验并继续探究:
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是______.
(2)小强为了确定该溶液是哪种溶液,他又进行了如下实验:
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 ______ | 产生大量的气泡 | 该溶液是______,反应的化学方程式 ______ |
反思与评价:小淇认为上述探究存在问题,她的理由是______.
Ⅱ.计算:某固体物质由MgSO4和NaOH组成,取24.0g该固体混合物溶于水后,向所得的混合物中逐滴加入质量分数为15%的硫酸溶液,加入的稀H2SO4的体积x(单位:mL)与所得沉淀质量y(单位:g)有如图所示的关系,求该固体混合物中NaOH、MgSO4的质量各为多少克?(写出计算过程)
【答案】分析:【交流讨论】根据酸、碱、盐的组成特点及标签可见部分,猜测该溶液不可能属于哪类物质的溶液;
【得出结论】根据溶液中溶质溶解度与饱和溶液中溶质的质量分数的关系,由常温下各物质的溶解度及该溶液中溶质质量分数,判断溶液的可能性;
【设计并实验】(1)根据三种物质溶液的酸碱性及所测定溶液的酸碱度,对溶液的可能做出判断;
(2)利用碳酸钠、氢氧化钠性质差异及所设计实验中的现象,判断所采取的鉴别所用试剂、现象及结论;
【拓展与应用】根据碳酸钠、氢氧化钠的性质差异,另选一种试剂完成两种物质的鉴别;
【反思与评价】根据氢氧化钠易于与二氧化碳反应也会产生碳酸钠分析;
物质之间的反应有2NaOH+H2SO4=Na2SO4+H2O,MgSO4+2NaOH=Na2SO4+Mg(OH)2↓,Mg(OH)2+H2SO4═MgSO4+2H2O;由图示数据可知,开始加入硫酸至29.7mL时,是因为硫酸在与氢氧化钠反应,A~B段是硫酸与氢氧化镁沉淀的反应,利用氢氧化镁与硫酸反应的化学方程式,可计算出MgSO4和NaOH反应生成沉淀的质量;然后再利用MgSO4和NaOH反应计算出固体物质中MgSO4的质量;然后NaOH的质量即可求出.
解答:解:【交流讨论】破损标签可见部分为钠元素,可判断该物质由金属元素与根组成,而酸类物质由氢元素与酸根所组成,可判断该物质不可能为酸;
【得出结论】根据常温下碳酸氢钠的溶液为9.6g,可判断常温下碳酸氢钠的饱和溶液的溶质质量分数=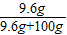 ×100%=8.8%<10%,因此可判断该溶液不可能为碳酸氢钠溶液;
×100%=8.8%<10%,因此可判断该溶液不可能为碳酸氢钠溶液;
【设计并实验】(1)由于氢氧化钠、碳酸钠溶液都为碱性,溶液pH都大于7,只有氯化钠溶液的pH=7,所以该瓶pH大于7的溶液不可能是氯化钠溶液;
(2)根据碳酸钠能与盐酸反应放出二氧化碳而氢氧化钠与盐酸反应无明显现象,因此,可推断鉴别两物质时所加入的试剂为稀盐酸,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,观察有气泡可说明该物质为碳酸钠,反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
【拓展与应用】利用CaCl2 或Ca(OH)2 等能与碳酸钠反应生成白色碳酸钙沉淀,而与氢氧化钠不能反应而无明显现象,可使用CaCl2 或Ca(OH)2 等鉴别NaOH溶液和Na2CO3溶液,共同的现象是产生白色沉淀;
【反思与评价】氢氧化钠易于与二氧化碳反应也会产生碳酸钠,因此上述探究存在问题的理由是该溶液也有可能是放置较长时间已变质的NaOH溶液;
解:由图示数据可知,与氢氧化镁沉淀反应的硫酸溶液的体积为:89mL-29.7mL=59.3mL,则H2SO4质量为:59.3mL×1.1g/mL×15%≈9.8g,
设参与反应的沉淀氢氧化镁的质量为x,
Mg(OH)2+H2SO4═MgSO4+2H2O
58 98
x 9.8g
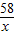 =
=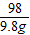
解之得:x=5.8g
②设参与反应的MgSO4的质量为y,
MgSO4+2NaOH=Na2SO4+Mg(OH)2↓,
120 58
y 5.8g
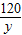 =
=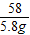
y=12g;
所以氢氧化钠的质量为24g-12g=12g
答:该固体中MgSO4的质量为12g;NaOH的质量为12g.
故答案为:【交流讨论】A;
【得出结论】NaHCO3;
【设计并实验】(1)NaCl; (2)稀盐酸(硫酸); Na2CO3; Na2CO3+2HCl=2NaCl+H2O+CO2↑;
【拓展与应用】CaCl2 或Ca(OH)2 等; 产生白色沉淀;
【反思与评价】该溶液也有可能是放置较长时间已变质的NaOH溶液;
Ⅱ.解:由图示数据可知,与氢氧化镁沉淀反应的硫酸溶液的体积为:89mL-29.7mL=59.3mL,则H2SO4质量为:59.3mL×1.1g/mL×15%≈9.8g,
设参与反应的沉淀氢氧化镁的质量为x,
Mg(OH)2+H2SO4═MgSO4+2H2O
58 98
x 9.8g
 =
=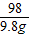
解之得:x=5.8g
②设参与反应的MgSO4的质量为y,
MgSO4+2NaOH=Na2SO4+Mg(OH)2↓,
120 58
y 5.8g
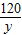 =
=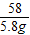
y=12g;
所以氢氧化钠的质量为24g-12g=12g
答:该固体中MgSO4的质量为12g;NaOH的质量为12g.
点评:本题考查了破损标签试剂的确定,综合利用了物质的组成、物质的溶解性、溶液的酸碱性及物质的变化规律对未知物质进行鉴别并利用化学方程式进行计算,解答时需认真分析图示数据和已知条件以及物质间反应的情况,才能正确解答,体现学生运用化学知识分析问题、解决问题的能力.
【得出结论】根据溶液中溶质溶解度与饱和溶液中溶质的质量分数的关系,由常温下各物质的溶解度及该溶液中溶质质量分数,判断溶液的可能性;
【设计并实验】(1)根据三种物质溶液的酸碱性及所测定溶液的酸碱度,对溶液的可能做出判断;
(2)利用碳酸钠、氢氧化钠性质差异及所设计实验中的现象,判断所采取的鉴别所用试剂、现象及结论;
【拓展与应用】根据碳酸钠、氢氧化钠的性质差异,另选一种试剂完成两种物质的鉴别;
【反思与评价】根据氢氧化钠易于与二氧化碳反应也会产生碳酸钠分析;
物质之间的反应有2NaOH+H2SO4=Na2SO4+H2O,MgSO4+2NaOH=Na2SO4+Mg(OH)2↓,Mg(OH)2+H2SO4═MgSO4+2H2O;由图示数据可知,开始加入硫酸至29.7mL时,是因为硫酸在与氢氧化钠反应,A~B段是硫酸与氢氧化镁沉淀的反应,利用氢氧化镁与硫酸反应的化学方程式,可计算出MgSO4和NaOH反应生成沉淀的质量;然后再利用MgSO4和NaOH反应计算出固体物质中MgSO4的质量;然后NaOH的质量即可求出.
解答:解:【交流讨论】破损标签可见部分为钠元素,可判断该物质由金属元素与根组成,而酸类物质由氢元素与酸根所组成,可判断该物质不可能为酸;
【得出结论】根据常温下碳酸氢钠的溶液为9.6g,可判断常温下碳酸氢钠的饱和溶液的溶质质量分数=
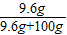 ×100%=8.8%<10%,因此可判断该溶液不可能为碳酸氢钠溶液;
×100%=8.8%<10%,因此可判断该溶液不可能为碳酸氢钠溶液;【设计并实验】(1)由于氢氧化钠、碳酸钠溶液都为碱性,溶液pH都大于7,只有氯化钠溶液的pH=7,所以该瓶pH大于7的溶液不可能是氯化钠溶液;
(2)根据碳酸钠能与盐酸反应放出二氧化碳而氢氧化钠与盐酸反应无明显现象,因此,可推断鉴别两物质时所加入的试剂为稀盐酸,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,观察有气泡可说明该物质为碳酸钠,反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
【拓展与应用】利用CaCl2 或Ca(OH)2 等能与碳酸钠反应生成白色碳酸钙沉淀,而与氢氧化钠不能反应而无明显现象,可使用CaCl2 或Ca(OH)2 等鉴别NaOH溶液和Na2CO3溶液,共同的现象是产生白色沉淀;
【反思与评价】氢氧化钠易于与二氧化碳反应也会产生碳酸钠,因此上述探究存在问题的理由是该溶液也有可能是放置较长时间已变质的NaOH溶液;
解:由图示数据可知,与氢氧化镁沉淀反应的硫酸溶液的体积为:89mL-29.7mL=59.3mL,则H2SO4质量为:59.3mL×1.1g/mL×15%≈9.8g,
设参与反应的沉淀氢氧化镁的质量为x,
Mg(OH)2+H2SO4═MgSO4+2H2O
58 98
x 9.8g
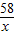 =
=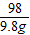
解之得:x=5.8g
②设参与反应的MgSO4的质量为y,
MgSO4+2NaOH=Na2SO4+Mg(OH)2↓,
120 58
y 5.8g
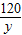 =
=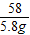
y=12g;
所以氢氧化钠的质量为24g-12g=12g
答:该固体中MgSO4的质量为12g;NaOH的质量为12g.
故答案为:【交流讨论】A;
【得出结论】NaHCO3;
【设计并实验】(1)NaCl; (2)稀盐酸(硫酸); Na2CO3; Na2CO3+2HCl=2NaCl+H2O+CO2↑;
【拓展与应用】CaCl2 或Ca(OH)2 等; 产生白色沉淀;
【反思与评价】该溶液也有可能是放置较长时间已变质的NaOH溶液;
Ⅱ.解:由图示数据可知,与氢氧化镁沉淀反应的硫酸溶液的体积为:89mL-29.7mL=59.3mL,则H2SO4质量为:59.3mL×1.1g/mL×15%≈9.8g,
设参与反应的沉淀氢氧化镁的质量为x,
Mg(OH)2+H2SO4═MgSO4+2H2O
58 98
x 9.8g
 =
=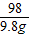
解之得:x=5.8g
②设参与反应的MgSO4的质量为y,
MgSO4+2NaOH=Na2SO4+Mg(OH)2↓,
120 58
y 5.8g
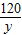 =
=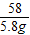
y=12g;
所以氢氧化钠的质量为24g-12g=12g
答:该固体中MgSO4的质量为12g;NaOH的质量为12g.
点评:本题考查了破损标签试剂的确定,综合利用了物质的组成、物质的溶解性、溶液的酸碱性及物质的变化规律对未知物质进行鉴别并利用化学方程式进行计算,解答时需认真分析图示数据和已知条件以及物质间反应的情况,才能正确解答,体现学生运用化学知识分析问题、解决问题的能力.

练习册系列答案
相关题目
Ⅰ.探究:实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%” 字样。已知它是无色液体,是初中化学常用的试剂。小强和小华同学很感兴趣,决定对其成分进行探究。
提出问题:这瓶试剂可能是什么溶液呢?
交流讨论:根据受损标签的情况判断,这瓶试剂不可能是 A.酸 B.碱 C.盐
查阅资料:
①初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
②Na2CO3和NaHCO3溶液都呈碱性。
③测定室温(20℃)时,四种物质的溶解度的数据如下:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
设计实验并继续探究:
①小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是 。
②小强为了确定该溶液是哪种溶液,他又进行了如下实验:
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 | 产生大量的气泡 | 该溶液是 ,反应的化学方程式 |
反思与评价:小淇认为上述探究存在问题,她的理由是 。
Ⅱ.计算:某固体物质由MgSO4和NaOH组成,取24.0g该固体混合物溶于水后,向所得的混合物中逐滴加入质量分数为15%的硫酸溶液(密度为1.1g·mL-1),加入的稀H2SO4的体积x(单位:mL)与所得沉淀质量y(单位:g)有如右下图所示的关系,
求该固体混合物中NaOH、MgSO4的质量各为多少克?(写出计算过程)

