题目内容
Ⅰ.探究:实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%” 字样。已知它是无色液体,是初中化学常用的试剂。小强和小华同学很感兴趣,决定对其成分进行探究。
提出问题:这瓶试剂可能是什么溶液呢?
交流讨论:根据受损标签的情况判断,这瓶试剂不可能是 A.酸 B.碱 C.盐
查阅资料:
①初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
②Na2CO3和NaHCO3溶液都呈碱性。
③测定室温(20℃)时,四种物质的溶解度的数据如下:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
设计实验并继续探究:
①小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是 。
②小强为了确定该溶液是哪种溶液,他又进行了如下实验:
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 | 产生大量的气泡 | 该溶液是 ,反应的化学方程式 |
反思与评价:小淇认为上述探究存在问题,她的理由是 。
Ⅱ.计算:某固体物质由MgSO4和NaOH组成,取24.0g该固体混合物溶于水后,向所得的混合物中逐滴加入质量分数为15%的硫酸溶液(密度为1.1g·mL-1),加入的稀H2SO4的体积x(单位:mL)与所得沉淀质量y(单位:g)有如右下图所示的关系,
求该固体混合物中NaOH、MgSO4的质量各为多少克?(写出计算过程)

解析试题分析:Ⅰ、交流讨论:由于酸的所有阳离子都是氢离子,故不可能含有钠离子,所以该溶液不可能是酸,故选A。
得出结论:根据表格可知,20℃时NaHCO3的溶解度是9.6g,根据饱和溶液的溶质质量分数= ×100﹪,可知20℃时其饱和溶液的溶质质量分数=
×100﹪,可知20℃时其饱和溶液的溶质质量分数=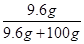 ×100﹪=8.8%,小于10%,所以不可能是碳酸氢钠。
×100﹪=8.8%,小于10%,所以不可能是碳酸氢钠。
①由于小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,而氯化钠溶液呈中性,即pH等于7,所以不可能是氯化钠。
②根据题意可知,可能的物质是NaOH或Na2CO3或二者皆有,再结合实验现象“产生大量的气泡”,可知滴加的溶液为酸(如稀盐酸等),因为Na2CO3+2HCl=2NaCl+H2O+CO2↑,故有气泡产生。
拓展与应用:根据碳酸盐的检验方法分析,碳酸根离子可以和钙离子或钡离子等反应生成沉淀,故可以选择钙盐等。
反思与评价:由于该实验只能验证出碳酸钠,而该溶液也有可能是放置较长时间的NaOH溶液,变质而生成碳酸钠。
Ⅱ、根据题意,向混合物中加入稀硫酸后,物质之间的反应有2NaOH+H2SO4=Na2SO4+H2O,MgSO4+2NaOH=Na2SO4+Mg(OH)2↓,Mg(OH)2+H2SO4=MgSO4+2H2O;由图示的数据可知,开始加入硫酸至29.7ml时,沉淀没有减少,这是因为硫酸在与氢氧化钠反应;而A~B段才是硫酸与氢氧化镁沉淀的反应,利用氢氧化镁与硫酸反应的化学方程式,结合图示中硫酸的量,列出比例式,就可计算出氢氧化镁沉淀的质量;再利用MgSO4和NaOH反应的化学方程式,列出比例式,可计算出固体物质中MgSO4的质量;再用固体质量-该固体中MgSO4的质量=NaOH的质量。
由图示数据可知,与氢氧化镁沉淀反应的硫酸溶液的体积为89.1ml-29.7ml=59.4ml,则H2SO4质量=59.4ml×1.1g/ml×15%≈9.8g.
设参与反应的氢氧化镁沉淀的质量为x,
Mg(OH)2+H2SO4=MgSO4+2H2O
58 98
x 9.8g
58:98 =x:9.8g ,
解得:x=5.8g
设参与反应的MgSO4的质量为y
MgSO4+2NaOH=Na2SO4+Mg(OH)2↓
120 58
y 5.8g
120:58 =y:5.8g
解得:y=12g
则该固体中NaOH的质量=24g-12g=12g
答:该固体中MgSO4的质量为12g,NaOH的质量为12g。
考点:缺失标签的药品成分的探究,证明碳酸盐,溶质的质量分数、溶解性和溶解度的关系,溶液的酸碱性与pH值的关系,氧化物、酸、碱和盐的概念,根据化学反应方程式的计算
点评:对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。

 阅读快车系列答案
阅读快车系列答案
提出问题:这瓶试剂可能是什么溶液呢?
交流讨论:根据受损标签的情况判断,这瓶试剂不可能是______
A.酸 B.碱 C.盐
查阅资料:①初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3.
②Na2CO3和NaHCO3溶液都呈碱性.
③测定室温(20℃)时,四种物质的溶解度的数据如下:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
设计实验并继续探究:
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是______.
(2)小强为了确定该溶液是哪种溶液,他又进行了如下实验:
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 ______ | 产生大量的气泡 | 该溶液是______,反应的化学方程式 ______ |
反思与评价:小淇认为上述探究存在问题,她的理由是______.
Ⅱ.计算:某固体物质由MgSO4和NaOH组成,取24.0g该固体混合物溶于水后,向所得的混合物中逐滴加入质量分数为15%的硫酸溶液,加入的稀H2SO4的体积x(单位:mL)与所得沉淀质量y(单位:g)有如图所示的关系,求该固体混合物中NaOH、MgSO4的质量各为多少克?(写出计算过程)
