题目内容
【题目】酸、碱、盐在生产生活中具有广泛的用途。
(1)A、B、C、D是初中化学常见物质,如图是包含A、B、C、D和盐酸5种物质的“化学拼图”,相邻两张卡片所标的物质间能发生反应。
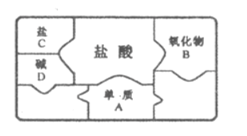
①单质A不可能是_____(填字母序号)。
A Mg B Fe C Ag D Zn
②若B为铁锈的主要成分![]() ,B与盐酸反应的化学方程式为_____。
,B与盐酸反应的化学方程式为_____。
③若C为碳酸钠,C与D反应的化学方程式为_____。将二氧化碳通入C溶液,可化合生成碳酸氢钠(![]() ),该反应的反应物有_____种。
),该反应的反应物有_____种。
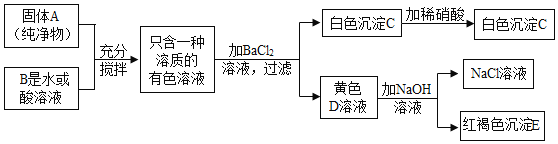
(2)某同学用天平称量一定量的含氯化镁、硫酸钠和氯化钙的粗盐,并设计了如下过程进行除杂提纯,试验后得到较纯净的氯化钠固体。(此题中微溶物视为可溶物)请回答下列问题:
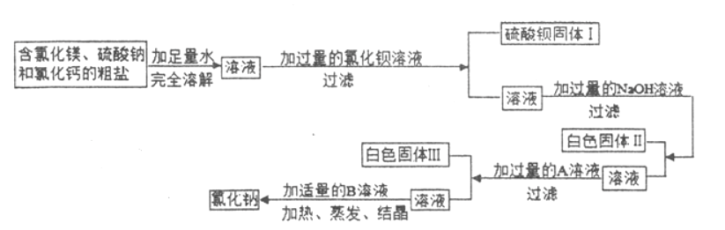
①写出这位同学所加的试剂:A_____(填化学式)。
②白色固体II的成分是_____(填化学式);
白色固体III的成分是_____(填化学式);
③加入适量B溶液的作用是除去_____。
【答案】C Fe2O3+6HCl=2FeCl3+3H2O Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 3 Na2CO3 Mg(OH)2 CaCO3和BaCO3 滤液中过量的氢氧化钠和碳酸钠
【解析】
(1)①单质能与酸反应,所以应该是氢前的金属,单质不可能是银,故填:C;
②若B为铁锈的主要成分Fe2O3,B与盐酸反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O,故填:Fe2O3+6HCl=2FeCl3+3H2O;
③若C为碳酸钠,D是碱,可以是氢氧化钙或氢氧化钡,C与D反应的化学方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH(合理即可),二氧化碳通入碳酸钠溶液与碳酸钠、水发生化合反应,此反应的反应物有3种,故填:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 3;
(2)根据题意:加过量的氯化钡溶液与硫酸钠溶液反应生成硫酸钡沉淀与氯化钠,加过量的氢氧化钠溶液与氯化镁反应生成氢氧化镁沉淀和氯化钠,所以白色固体II是氢氧化镁,化学式为Mg(OH)2;再加入过量的碳酸钠将氯化钙和过量的氯化钡反应生成白色固体III,所以白色固体III的成分是碳酸钙沉淀和碳酸钡沉淀,碳酸钠的化学式为Na2CO3,碳酸钙的化学式为CaCO3,碳酸钡的化学式为BaCO3;过滤后再加适量的稀盐酸将过量的氢氧化钠和碳酸钠除去,所以适量的B溶液是稀盐酸,其作用是除去滤液中过量的氢氧化钠和碳酸钠。故填:Na2CO3 Mg(OH)2 CaCO3和BaCO3 滤液中过量的氢氧化钠和碳酸钠