��Ŀ����
(3��)��ش������йؽ��������⡣
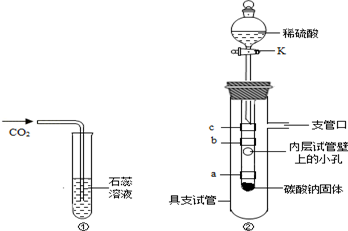
(1)�ұ���ij̽��ʵ��װ��ͼ��һ��ʱ����ܹ۲쵽ʲô����?(װ�����������ã��ҿ�ʼʱU�����˵ĺ�īˮҺ����ƽ)

(2)X��Y��Z�����ֽ������壬��X��Y����ϡ�����У�Y�ܽⲢ����������X�ޱ仯����X��Z������������Һ�У�X��������������Z�ޱ仯��
���ж�X��Y��Z�������ֽ����Ļ����ǿ������˳��
�ھ���ȷ��һ��X��д��X����������Һ��Ӧ�Ļ�ѧ����ʽ��
(1)�ұ���ij̽��ʵ��װ��ͼ��һ��ʱ����ܹ۲쵽ʲô����?(װ�����������ã��ҿ�ʼʱU�����˵ĺ�īˮҺ����ƽ)

(2)X��Y��Z�����ֽ������壬��X��Y����ϡ�����У�Y�ܽⲢ����������X�ޱ仯����X��Z������������Һ�У�X��������������Z�ޱ仯��
���ж�X��Y��Z�������ֽ����Ļ����ǿ������˳��
�ھ���ȷ��һ��X��д��X����������Һ��Ӧ�Ļ�ѧ����ʽ��
��1���������⣬U��Һ���Ϊ����ҵ͡���1�֣�
(2) ��Y��X��Ag��Z ��1�֣� ��Cu + 2AgN03===Cu(N03)2 + 2Ag ��1�֣�
(2) ��Y��X��Ag��Z ��1�֣� ��Cu + 2AgN03===Cu(N03)2 + 2Ag ��1�֣�
��1��������������ˮͬʱ�Ӵ������⣬�������ܱ��Թ��ڵ�������ʹ��ѹǿ��С��������ѹ���䣬��U���Ҳ�Һ���½������Һ��������
��2����Y����ϡ���ᷴӦ��X���ܣ���ɵ�Y�Ļ�Դ����⣬X�Ļ��С���⣬����Y��H��X��X��Z������������Һ�У�X������Ag������Z�ޱ仯��X�Ļ�Դ���Ag����Z�Ļ��С��Ag����X��Ag��Z��������������Y��X��Ag��Z��
��X������棬��X�Ļ�Դ���Ag����X����Ϊͭ��������������Һ��Ӧ�Ļ�ѧ����ʽΪCu + 2AgN03===Cu(N03)2 + 2Ag��
��2����Y����ϡ���ᷴӦ��X���ܣ���ɵ�Y�Ļ�Դ����⣬X�Ļ��С���⣬����Y��H��X��X��Z������������Һ�У�X������Ag������Z�ޱ仯��X�Ļ�Դ���Ag����Z�Ļ��С��Ag����X��Ag��Z��������������Y��X��Ag��Z��
��X������棬��X�Ļ�Դ���Ag����X����Ϊͭ��������������Һ��Ӧ�Ļ�ѧ����ʽΪCu + 2AgN03===Cu(N03)2 + 2Ag��

��ϰ��ϵ�д�
�����Ŀ