题目内容
【题目】水是生命之源,是自然界中重要的物质。
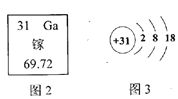
(1)如图是某矿泉水的标签中的一部分。

①请写出标签中符合下列要求的微粒的化学符号:
镁离子________ 硫酸根离子 _______
②该天然矿泉水产地儿童智力发育较好可能与矿泉水中的_____元素有关,它属于人体必需的____元素(填“微量”或“常量”)。
③该矿泉水为______(填“纯净物”或“混合物”)。
(2)自来水的生产过程如下左图:
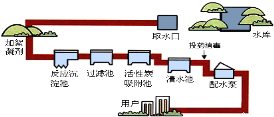
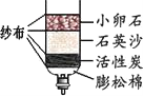
①生活中将硬水进行软化的方法是_____。
②“投药消毒”这一步是______ 变化(填“物理”“化学”)。
③自制净化器(见右图)中用到活性炭,主要是利用其_______性,石英沙和小卵石的作用是________。
(3)电解水的图示如下:
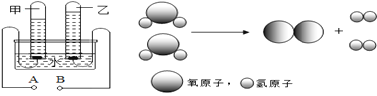
电解水通常用直流电,图中正极是____ 端(填“A”、“B”), 甲管中气体具有__ (填“可燃性”“助燃性”);在90g水中加入4g氢氧化钠(NaOH)的作用是_______,电解前溶液中氢元素的质量为_______g,电解后溶液中氢氧化钠的质量分数_______(填“变大”、“变小”或“不变”)。写出电解水的化学方程式____________ ,能够保持氧气化学性质的最小微粒是下列中的 ________ (填字母)。
![]()
【答案】Mg2+ SO42- 锌或Zn 微量 混合物 煮沸 化学 吸附 过滤 B 可燃性 增强导电性 10.1 变大 2H2O![]() 2H2↑+ O2↑ b
2H2↑+ O2↑ b
【解析】
(1)①一个镁离子带两个单位的正电荷,一个硫酸根离子由一个硫原子与四个氧原子构成,一个硫酸根离子带两个单位的负电荷。②锌元素与儿童智力发育有关,它属于人体必需的微量元素。③矿泉水中含有多种物质,属于混合物。
(2)①生活中用煮沸的方法降低水的硬度。②“投药消毒”是化学变化。③活性炭具有吸附性,能除去异味和色素,石英沙和小卵石的作用是过滤,可除去一些难溶解的固体物质。
(3)电解水时,正氧负氢,氢二氧一,图中甲试管中的气体多,是氢气,与其相连一端是负极,故正极是B端,甲管中的氢气具有可燃性;纯净的水几乎不导电,在水中加入氢氧化钠的作用是增强水的导电性。电解前溶液中氢元素的质量是90gH2O中氢元素的质量加上4gNaOH中氢元素的质量,为90g×![]() +4g×
+4g×![]() =10.1g,电解过程中氢氧化钠的质量不变,电解后溶液中溶剂水的质量减少,所以电解后溶液中氢氧化钠的质量分数变大,电解水生成氢气和氧气。分子是保持物质化学性质的最小微粒,能够保持氧气化学性质的最小微粒是氧分子,一个氧分子由两个氧原子构成,一个氢分子由两个氢原子构成,氧原子比氢原子大,故选b。
=10.1g,电解过程中氢氧化钠的质量不变,电解后溶液中溶剂水的质量减少,所以电解后溶液中氢氧化钠的质量分数变大,电解水生成氢气和氧气。分子是保持物质化学性质的最小微粒,能够保持氧气化学性质的最小微粒是氧分子,一个氧分子由两个氧原子构成,一个氢分子由两个氢原子构成,氧原子比氢原子大,故选b。

【题目】化学与生活、生产密切相关。
(1)我国首架大型客机C919中使用了大量的铝镁合金,铝制品在空气中不易被腐蚀,具有“自我保护”能力,其原因是_____(用化学方程式表示)。
(2)铝、铜、银是日常生活中接触到的三种金属。同学甲设计了如下三个实验来验证它们的金属活动性强弱:① 铝、硝酸银溶液;②铜、硫酸铝溶液;③铜、硝酸银溶液。同学乙认为这一方案中实验 ______(填“①”、“②”、“③”)可以不做,也能验证三个金属的活动性强弱。请写出实验③中的实验现象______。
(3)中国南海海底有大量的可燃冰(CH4·nH2O)。
① 可燃冰中,水分子形成一种空间笼状结构,甲烷和少量N2、CO2等分子填入笼内空隙中,无固定的化学计量关系,因此可燃冰属于________(选填“纯净物”或“混合物”)。
②甲烷在一定量的氧气中燃烧,测得反应前后各物质的质量如下表所示:
物质 | 甲烷 | 氧气 | 水 | 二氧化碳 | 一氧化碳 |
反应前质量/g | 3.2 | 11.2 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | 未测 |
根据表格中数据,请完成甲烷在一定量的氧气中燃烧的化学方程式 _______。
(4)某工厂利用废硫酸与废铁屑反应制取硫酸亚铁。现制得FeSO4 1.52 t,需要铁的质量至少是多少?(在答题卡上写出计算过程)_______