题目内容
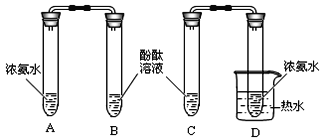
【题目】实验室有一瓶保存不当的试剂(如图所示),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小华等几位同学很感兴趣,决定对其成分进行探究.
![]()
(提出问题)这瓶试剂溶质是什么?
(交流研讨)根据受损标签的情况判断,这瓶试剂不可能是 ______ (填字母序号).
A 酸B 碱C 盐
(查阅资料)
①初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3.
②Na2CO3、NaHCO3溶液都呈碱性.NaCl溶液呈中性.
③室温下(20℃)时,4种物质的溶解度的数据如下.
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 36 | 109 | 215 | 9.6 |
(得出结论)小华根据试剂瓶上标注和上表溶解度数据判断,这瓶试剂不可能是 ______ .
(猜想与实验)①可能是 ______ 溶液;②可能是NaOH溶液;③可能是NaCl溶液.
(1)小亮用洁净的玻璃棒蘸取该溶液,滴到湿润的pH试纸上,测得pH=11,他判断该溶液不可能是氯化钠.对小亮的操作方法、测量结果及所得结论,你的评价是 ______ .
A 方法正确,结果正确,结论正确B 方法不正确,结果偏小,但结论正确
C 方法不正确,结果偏大,结论不正确D 方法正确,结果正确,但结论不正确
(2)小强为了确定该溶液的成分,进行了如下实验.
操作步骤 | 实验现象 | 结论及化学方程式 |
步骤一:取样品于试管中,滴加足量 ______ | 产生大量的气泡 | 猜想①正确. 步骤一发生反应的化学方程式是 ______ |
步骤二:把产生的气体,通入 ______ | ______ |
(质疑)小华则不同意小强的观点,认为溶液中有Na2CO3还可能有NaOH.请你帮助他完成以下探究方案:
探究步骤 | 预计现象 | 结论 |
步骤一:取样品于试管中,向其中滴加足量的 ______ 溶液并过滤 | 产生白色沉淀 | 溶液中: 既含Na2CO3,又含有NaOH |
步骤二:向上述滤液中滴加酚酞试液 | 酚酞试液变 ______ 色 |
(反思)NaOH溶液会因接触空气而变质,写出该反应的化学方程式 ______ ;配制一定质量分数的NaOH溶液时,需将氢氧化钠固体放在天平左盘上的 ______ 中进行称量.
【答案】A NaHCO3 Na2CO3 B 稀盐酸 澄清石灰水 石灰水变浑浊 Na2CO3+2HCl═2NaCl+CO2↑+H2O CaCl2(或BaCl2等) 红 CO2+2NaOH═Na2CO3+H2O 小烧杯
【解析】
[交流研讨]破损标签可见部分为钠元素,而酸类物质由氢元素与酸根所组成,可判断该物质不可能为酸;
[得出结论]根据常温下碳酸氢钠的溶液为9.6g,可判断常温下碳酸氢钠的饱和溶液的溶质质量分数=![]() ×100%=8.8%<10%,因此可判断该溶液不可能为碳酸氢钠溶液;
×100%=8.8%<10%,因此可判断该溶液不可能为碳酸氢钠溶液;
[猜想与实验]除碳酸氢钠外,该溶液可能为氯化钠、碳酸钠或氢氧化钠溶液;
[设计并实验](1)由于氢氧化钠、碳酸钠溶液都为碱性,溶液pH都大于7,但在用洁净的玻璃棒蘸取该溶液,滴到湿润的pH试纸上,试纸用水润湿,会使溶液的碱性减弱,导致pH偏小,因此该测定方法不正确,使结果偏小,但能得出溶液显碱性的结论,故选择B;
(2)根据碳酸钠能与盐酸反应放出二氧化碳而氢氧化钠与盐酸反应无明显现象,因此,可推断鉴别两物质时所加入的试剂为稀盐酸,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,反应的方程式为:Na2CO3+2HCl═2NaCl+CO2↑+H2O,观察有气泡可说明该物质为碳酸钠,把产生气体通入澄清石灰水,石灰水会变浑浊;
[质疑]由于氢氧化钠溶液和碳酸钠溶液都呈碱性,因此想证明氢氧化钠的存在,首先得先把碳酸钠除去,碳酸根离子与钙离子或钡离子能结合成沉淀,因此可先用氯化钙溶液或其它可溶性的钙盐或钡盐溶液(氯化钡、硝酸钙、硝酸钡)除去碳酸钠,再滴入酚酞试液,酚酞试液变红,证明氢氧化钠的存在;
[反思]氢氧化钠溶液和空气中的二氧化碳反应产生碳酸钠和水,反应的方程式为:CO2+2NaOH═Na2CO3+H2O;由于氢氧化钠具有强腐蚀性,故应该在小烧杯里称量,以防腐蚀纸和托盘天平的托盘。

【题目】化学方程式的书写是学好化学的关键,但是很多同学在刚刚学习化学方程式书写时常常会犯一些错误,具体概括如下:①生成物化学式书写错误 ②未配平 ③遗漏反应条件 ④“↑”或“↓”使用不当,请你判断下列化学方程式的错误类型(填序号)。
序号 | 化学方程式 | 错误类型 |
(1) | 镁条燃烧:Mg+O2 | ______ |
(2) | 用硫酸铜溶液和氢氧化钠溶液混合: CuSO4+NaOH=Na2SO4+Cu(OH)2↓ | _____ |
(3) | 高炉冶炼赤铁矿:3CO+Fe2O3=Fe + 3CO2↑ | ____ |