题目内容
硝酸铵是农业生产中常用的化学肥料。为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取2.0 g该硝酸铵样品于容器中,滴入5.0 g 20%的NaOH溶液。发生如下反应:NH4NO3+NaOH===NaNO3+NH3↑+H2O。反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:
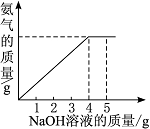
完成有关计算:
(1)NH4NO3中各元素的质量比为[m(H)∶m(N)∶m(O)]__________。
(2)样品中硝酸铵的质量分数。
(3)所得溶液中NaNO3的质量分数(保留两位小数)。
答案:(1)1∶7∶12
(2)解:设2.0 g样品中含NH4NO3的质量为x,反应生成NaNO3的质量为y,反应生成的NH3的质量为z,则
NH4NO3+NaOH===NaNO3+NH3↑+H2O
80 40 85 17
x 4 g×20% y z
x=1.6 g
y=1.7 g
z=0.34 g
样品中NH4NO3的质量分数为: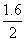 ×100%=80%
×100%=80%
(3)反应后所得溶液中NaNO3的质量分数为:
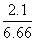 ×100%≈31.5%
×100%≈31.5%

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
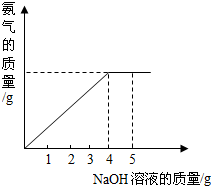 硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如右图所示:
硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如右图所示: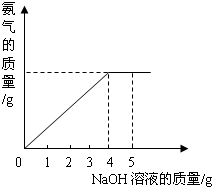 硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:
硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示: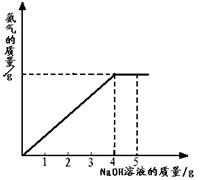 硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:
硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示: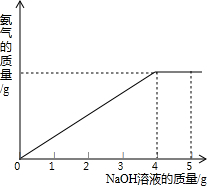 硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入20%的NaOH溶液.发生如下反应:
硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入20%的NaOH溶液.发生如下反应: 硝酸铵是农业生产中常用的化学肥料.为测定某含有少量 NaNO3的硝酸铵样品中NH4NO3的纯度,取2.0g该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示.请完成有关计算:
硝酸铵是农业生产中常用的化学肥料.为测定某含有少量 NaNO3的硝酸铵样品中NH4NO3的纯度,取2.0g该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示.请完成有关计算: