题目内容
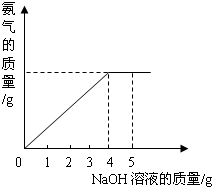 硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:
硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:完成有关计算:
(1)NH4NO3中各元素的质量比为(H:N:O)
(2)样品中硝酸铵的质量分数;
(3)所得溶液中NaNO3的质量分数(保留两位小数).
分析:(1)物质中各元素的质量比为各原子的相对原子质量乘以原子的个数的积之比.
(2)从图中可看出氢氧化钠溶液滴加到4克时硝酸铵恰好完全反应,根据参加反应的氢氧化钠的质量求出硝酸铵的质量,再用
×100%求出样品中硝酸铵的质量分数.
(3)根据参加反应的氢氧化钠的质量求出生成的硝酸钠的质量,用生成的硝酸钠的质量+原有的硝酸钠的质量为所得溶液中硝酸钠的质量;用样品的质量+所加氢氧化钠溶液的质量-氨气的质量(氨气的质量可根据氢氧化钠的质量求出)为所得溶液的质量;再根据
×100%即可求出所得溶液中硝酸钠的质量分数.
(2)从图中可看出氢氧化钠溶液滴加到4克时硝酸铵恰好完全反应,根据参加反应的氢氧化钠的质量求出硝酸铵的质量,再用
| 硝酸铵的质量 |
| 样品的质量 |
(3)根据参加反应的氢氧化钠的质量求出生成的硝酸钠的质量,用生成的硝酸钠的质量+原有的硝酸钠的质量为所得溶液中硝酸钠的质量;用样品的质量+所加氢氧化钠溶液的质量-氨气的质量(氨气的质量可根据氢氧化钠的质量求出)为所得溶液的质量;再根据
| 所得溶液中硝酸钠的质量 |
| 所得溶液的质量 |
解答:解:(1)硝酸铵中氢元素、氮元素、氧元素的质量比=1×4:14×2:16×3=1:7:12
(2)设2.0g样品中含NH4NO3的质量为ⅹ,反应生成NaNO3的质量为y,反应生成的NH3的质量为z,
NH4NO3+NaOH═NaNO3+NH3↑+H2O
80 40 85 17
ⅹ4g×20% y z
=
=
=
x=1.6g y=1.7g z=0.34g
样品中硝酸铵的质量分数=
×100%=80.00% 答:样品中硝酸铵的质量分数为80.0%.
(3)所得溶液中硝酸钠的质量=2.00g-1.60g+1.70g=2.1g
所得溶液的质量=2.00g+5.0g-0.34g=6.66g
所得溶液中硝酸钠的质量分数=
×100%=31.53%
答:所得溶液中硝酸钠的质量分数为31.53%
(2)设2.0g样品中含NH4NO3的质量为ⅹ,反应生成NaNO3的质量为y,反应生成的NH3的质量为z,
NH4NO3+NaOH═NaNO3+NH3↑+H2O
80 40 85 17
ⅹ4g×20% y z
| 80 |
| 40 |
| x |
| 0.8g |
| 85 |
| 40 |
| y |
| 0.8g |
| 17 |
| 40 |
| z |
| 0.8g |
x=1.6g y=1.7g z=0.34g
样品中硝酸铵的质量分数=
| 1.6g |
| 2g |
(3)所得溶液中硝酸钠的质量=2.00g-1.60g+1.70g=2.1g
所得溶液的质量=2.00g+5.0g-0.34g=6.66g
所得溶液中硝酸钠的质量分数=
| 2.1g |
| 6.66g |
答:所得溶液中硝酸钠的质量分数为31.53%
点评:做本道题时要将4克氢氧化钠溶液和5克氢氧化钠溶液区分清,不能乱用,参加反应的氢氧化钠溶液的质量是4克,所加的氢氧化钠溶液的质量是5克.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
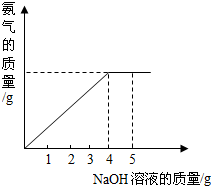 硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如右图所示:
硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如右图所示: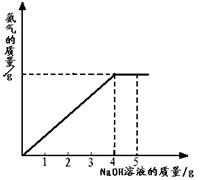 硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:
硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示: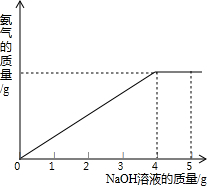 硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入20%的NaOH溶液.发生如下反应:
硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入20%的NaOH溶液.发生如下反应: 硝酸铵是农业生产中常用的化学肥料.为测定某含有少量 NaNO3的硝酸铵样品中NH4NO3的纯度,取2.0g该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示.请完成有关计算:
硝酸铵是农业生产中常用的化学肥料.为测定某含有少量 NaNO3的硝酸铵样品中NH4NO3的纯度,取2.0g该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示.请完成有关计算: