题目内容
溶质的质量分数为20%的某二价金属的硫酸盐溶液200克,其中含硫元素8克.此二价金属的原子量为
- A.24
- B.56
- C.64
- D.65
C
分析:根据二价金属的硫酸盐可设出化学式,再设出金属的相对原子质量,利用含硫元素的质量来列式计算.
解答:因金属为二价,则硫酸盐的化学式课设为MSO4,M的相对原子质量为x,
根据硫酸盐中S元素的质量为8g,则
200g×20%×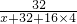 ×100%=8g,
×100%=8g,
解得x=64,
故选C.
点评:本题考查学生利用质量分数的计算来求金属的相对原子质量,学生应注意二价金属,然后采用正向思维设出化学式来解答.
分析:根据二价金属的硫酸盐可设出化学式,再设出金属的相对原子质量,利用含硫元素的质量来列式计算.
解答:因金属为二价,则硫酸盐的化学式课设为MSO4,M的相对原子质量为x,
根据硫酸盐中S元素的质量为8g,则
200g×20%×
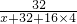 ×100%=8g,
×100%=8g,解得x=64,
故选C.
点评:本题考查学生利用质量分数的计算来求金属的相对原子质量,学生应注意二价金属,然后采用正向思维设出化学式来解答.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目

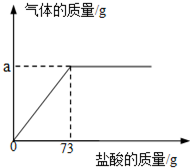 为了测定生铁中铁的质量分数,某校化学学习小组进行了实验研究,取6g生铁与溶质的质量分数为10%的盐酸反应(生铁中杂质不溶于水,也不与盐酸、硫酸铜溶液反应),并绘制了加入盐酸质量与放出气体质量的关系图.
为了测定生铁中铁的质量分数,某校化学学习小组进行了实验研究,取6g生铁与溶质的质量分数为10%的盐酸反应(生铁中杂质不溶于水,也不与盐酸、硫酸铜溶液反应),并绘制了加入盐酸质量与放出气体质量的关系图.