题目内容
【题目】课外探究小组对实验教师提供的一包白色固体(可能是NaCl、Na2SO4、Na2CO3和NaNO3的一种或几种)进行了下面的实验,且每步实验中均加入足量的试剂,至充分反应。实验过程、现象见下图:
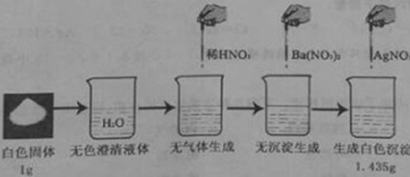
请分析实验过程并完成以下问题:
(1)实验中不能用稀盐酸代替稀硝酸的原因是 ;
(2)滴加Ba(NO3)2的目的是 ;
(3)通过计算推断:原白色固体的成分为 。(简单写出必要的计算过程)。
【答案】防止稀盐酸与AgNO3溶液反应,对判断是否含有NaCl造成干扰;检验白色固体中是否含有Na2SO4 ;NaCl:0.585g 、NaNO3:0.415g
【解析】
试题分析:注意原有固体可能有的成分:NaCl、Na2SO4、Na2CO3和NaNO3;(1)稀盐酸中也含有氯离子,防止稀盐酸与AgNO3溶液反应,对判断是否含有NaCl造成干扰;(2)加稀硝酸无气体产生,故原固体中不含碳酸钠,故滴加Ba(NO3)2的目的是检验是否含有硫酸根即Na2SO4;(3)结合前面的实验现象可知,原固体中不含碳酸钠和硫酸钠;只有氯化钠能与硝酸银生成沉淀,通过化学方程式可计算出原固体中氯化钠的质量,进而确定原固体的成分;计算过程如下:
原白色固体中氯化钠的质量为x,
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5
x 1.435g
![]()
x=0.585g 故原白色固体中还含有NaNO3,其质量为:1g-0.585g=0.415g。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目