题目内容
【题目】南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源.
(1)海水制盐.从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a 加过量的Ba(OH)2溶液;b 加稍过量的盐酸;c 加过量的Na2CO3溶液;d 过滤;e 蒸发.正确的操作顺序是 (填字母).加Na2CO3溶液的作用是除去 .
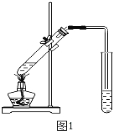
(2)海水淡化.如图1是一个简易的蒸馏法淡化海水的装置,证明得到的水是淡水的方法是 .
(3)海水制镁.从海水中提取金属镁的过程如图2所示:

在上述转化过程中发生中和反应的是 (填反应顺序号),海水中本身就含有氯化镁,则①、②两步的作用是 .
(4)海水“制碱”.氨碱法制纯碱是先通过化学反应生成NaHCO3和NH4Cl,NaHCO3结晶析出,再加热NaHCO3制得纯碱.
①氨碱法制纯碱中生成NaHCO3和NH4Cl的化学方程式为 ;
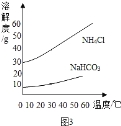
②反应中生成NaHCO3和NH4Cl的质量比为84:53.5,NaHCO3和NH4Cl的溶解度曲线如图3所示,请分析NaHCO3结晶析出而NH4Cl没有结晶析出的原因是 .
【答案】(1)acdbe;CaCl2和过量的Ba(OH)2;
(2)蒸干后没有晶体析出蒸干后没有晶体析出(或滴加硝酸银溶液,没有白色沉淀出现等合理答案也可);
(3)②;将氯化镁富集起来;
(4)生成的NaHCO3质量比NH4Cl多且溶解度比NH4Cl小,先达到饱和.
【解析】(1)要除去粗盐中含有的杂质,可以加过量的氢氧化钡溶液除去硫酸镁,加过量的Na2CO3溶液除去氯化钙和过量试剂氢氧化钡,通过过滤把不溶于水的物质除去,加适量的盐酸除去过量的碳酸钠,通过蒸发除去盐酸,故答案为:acdbe;CaCl2和过量的Ba(OH)2;
(2)蒸馏水是纯净物,蒸干后不留任何痕迹,即蒸干后没有晶体析出;或滴加硝酸银溶液,没有白色沉淀出现等合理答案也可;
故答案:蒸干后没有晶体析出蒸干后没有晶体析出(或滴加硝酸银溶液,没有白色沉淀出现等合理答案也可);
(3)根据酸和碱生成盐和水的反应是中和反应,反应②中氢氧化镁和稀盐酸反应生成氯化镁和水,加入石灰乳(比较经济,不能用氢氧化钠),变为氢氧化镁沉淀,过滤后加入盐酸制备氯化镁,再经过蒸发干燥制备无水氯化镁,最后经过通电可制得镁;通过前两步反应我们将氯化镁富集起来,故答案:②;将氯化镁富集起来;
(4)①氨碱法制纯碱中生成NaHCO3和NH4Cl的反应方程式为:NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl;
②反应中生成NaHCO3和NH4Cl的质量比为84:53.5,比NH4Cl多且溶解度比NH4Cl小,因此先达到饱和,
故答案:生成的NaHCO3质量比NH4Cl多且溶解度比NH4Cl小,先达到饱和.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】现甲、乙两化学小组安装两套如图1相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素.

(1)下列方法能检查该装置气密性的是 .
A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差.
B、关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差.
C、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差.
(2)MnO2催化下H2O2分解的化学方程式是 ;
(3)甲小组有如表实验设计方案,完成如表.
实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
甲组实验Ⅰ | 探究 对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%H2O2 |
甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
(4)甲、乙两小组得出如图2数据.
①甲组实验得出的数据可知:浓度越大,H2O2分解速率 ;
②由乙组研究的酸、碱对H2O2分解影响因素的 数据分析:相同条件下,H2O2在 填“酸”或“碱”)性环境下放出气体速率较快;乙组提出可以用Ba02固体与硫酸溶液反应制H202(已知还生成另一种物质),其化学反应方程式为 ;支持这一方案的理由是 .
【题目】从分子的角度分析并解释下列事实,不正确的是( )
选项 | 事实 | 解释 |
A | 碘酒是混合物 | 由不同种分子构成 |
B | 端午时节粽飘香 | 分子在不断运动着 |
C | 气体受热膨胀 | 温度升高,分子自身体积增大 |
D | 固体碘受热升华 | 碘分子间的间隔变大 |