题目内容
根据“20℃时,氯化钠的溶解度是36g”这句话的含义,判断下列说法中正确的是( )
分析:溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量;溶解度定义中的四要素:一定温度、100g溶剂、溶液达到饱和状态、溶解的质量及单位克.
解答:解:根据溶解度的概念,20℃时氯化钠的溶解度是36g,其涵义是20℃时,100g水中最多溶解36g氯化钠,形成饱和溶液136g,溶液达到饱和状态.
A、在20℃时,136g饱和氯化钠溶液中含有36g氯化钠,故选项说法错误.
B、该选项中由于没有指明温度,故选项说法错误.
C、在20℃时,把136g氯化钠溶液蒸干,可以得到36g氯化钠,故选项说法正确.
D、在20℃时,氯化钠饱和溶液中溶质与溶液的质量比为36:136,故选项说法错误.
故选:C.
A、在20℃时,136g饱和氯化钠溶液中含有36g氯化钠,故选项说法错误.
B、该选项中由于没有指明温度,故选项说法错误.
C、在20℃时,把136g氯化钠溶液蒸干,可以得到36g氯化钠,故选项说法正确.
D、在20℃时,氯化钠饱和溶液中溶质与溶液的质量比为36:136,故选项说法错误.
故选:C.
点评:本题难度不大,理解溶解度的概念,熟记溶解度的四要素(温度、100g溶剂、饱和状态、单位是克)是正确解答本题的关键.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
 铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.
铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.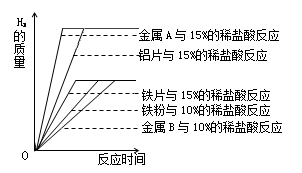

 铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.
铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.