题目内容
【题目】水和溶液在生产生活中起着重要的作用。
(1)电解水实验可以得出水的组成,该反应的化学方程式为________。
(2)过滤是净化水的方法之一。在实验室进行过滤操作时应注意做到“一贴、二低、三靠”,其中的“二低”是指_________、_____。
(3)现将300g 25%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为____g;配制的主要步骤有:计算、_____、混匀、装瓶并贴上标签;实验中用到的玻璃仪器是______和试剂瓶。
(4)①甲、乙两物质的溶解度曲线如图所示。20℃时,将等质量的甲、乙两种固体,分别加入盛有10 g水的A、B试管中,充分溶解后,可观察到如图所示的现象。则20℃_______t℃(填“>”、“<”或“=”)。
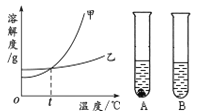
②20℃时,对A试管进行如下操作,最终A试管中溶液溶质的质量分数一定发生变化的是________(填字母序号)。
A.加少量水 B.加入少量甲物质
C.升温到40℃ D.蒸发部分溶剂,恢复到20℃
【答案】 2H2O![]() 2H2↑+O2↑ 滤纸边缘低于漏斗边缘 漏斗内液面低于滤纸边缘 450 量取 量筒、玻璃棒、烧杯、胶头滴管 < C
2H2↑+O2↑ 滤纸边缘低于漏斗边缘 漏斗内液面低于滤纸边缘 450 量取 量筒、玻璃棒、烧杯、胶头滴管 < C
【解析】(1)水在通电条件下分解生成氧气和水,化学方程式为2H2O 通电 2H2↑+ O2↑。
(2)过滤操作时应注意做到“一贴、二低、三靠”,其中的“二低”是指液面低于滤纸边缘、滤纸低于漏斗边缘。(3)将300g 25%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为x, 300g× 25%=(300g+x)×10%,x=450g;配制的主要步骤有:计算、称量、混匀、装瓶并贴上标签;实验中用到的玻璃仪器是量筒、玻璃棒、烧杯、胶头滴管和试剂瓶。(4)①20℃时,甲有固体剩余,而乙完全溶解,说明该温度下甲的溶解度比乙的小,则20℃<t℃;②A.加少量水,溶质的质量分数减小;B.加入少量甲物质,溶质的质量增加,溶质的质量分数增大;C.升温到40℃ ,甲的溶解度变大,溶质、溶剂都不变,溶质的质量分数不变; D.蒸发部分溶剂,恢复到20℃,溶剂减少,溶质不变,溶质的质量分数增大。最终A试管中溶液溶质的质量分数一定发生变化的是ABD

 阅读快车系列答案
阅读快车系列答案【题目】化学是一门以实验为基础的科学。
(1)控制变量是实验探究的重要方法,完成下表:
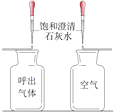
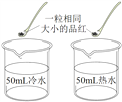
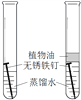
实验 | 探究人体吸入的空气与呼出的气体有什么不同 | 探究分子的运动 | 探究铁制品锈蚀的条件 |
设计 |
|
|
|
分析 | 本实验需要控制: ①集气瓶规格相同; ②________相同。 | 本实验说明: ①分子在不断运动; ②影响分子运动速率的因素有__________。 | 本实验说明: 铁制品锈蚀的条件之一是与__________接触。 |
(2)某化学学习小组在实验室练习配制一定溶质质量分数的溶液。
①配制50g质量分数为6%的氯化钠溶液,需要氯化钠的质量为__________g;用托盘天平称量所需的氯化钠时,若指针偏向左盘,应__________(填字母)至天平平衡。
A.增加氯化钠 B.减少氯化钠 C.向左移动游码 D.向右移动游码
②把50g质量分数为6%的氯化钠溶液稀释成质量分数为4%的氯化钠溶液,需要水的体积为__________mL(水的密度可近似看作1g/cm3);用量筒量取所需的水时,若俯视读数,得到的氯化钠溶液的质量分数__________(填“大于”、“小于”或“等于”)4% 。