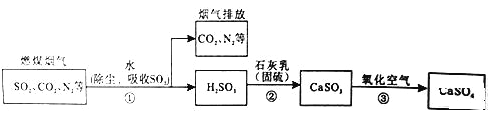
题目内容
【题目】根据下图所示装置回答有关问题:
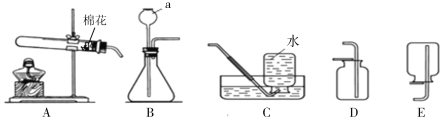
(1)写出标号仪器的名称 a 。
(2)用高锰酸钾制取氧气的化学方程式为 ,
可选择的发生装置是 (填字母)。
(3)实验室制取二氧化碳的化学方程式为 ,可选择的收集装置是 (填字母)。
(4)①实验室若要配制5%的双氧水150g,需要30%双氧水(密度1.1g/cm3) mL。(结果保留一位小数)
②某同学取68g上述配制好的双氧水用于实验室制氧气,理论上最多可产生氧气的质量多少?(写出计算过程)
【答案】
(1) 长颈漏斗
(2) 2KMnO4![]() K2MnO4+MnO2+O2↑ A
K2MnO4+MnO2+O2↑ A
(3)CaCO3 + 2HCl=CaCl2 + H2O + CO2↑ D
(4)①22.7② 1.6克
【解析】
试题分析:用高锰酸钾制取氧气的化学方程式为 2KMnO4![]() K2MnO4+MnO2+O2↑,可选择的发生装置是A,因为过程中需要加热。实验室制取二氧化碳的化学方程式为CaCO3 + 2HCl=CaCl2 + H2O + CO2↑,可选择的收集装置是D,因为二氧化碳的密度大于空气。①实验室若要配制5%的双氧水150g,需要30%双氧水(密度1.1g/cm3)=5%×150g÷(30%×1.1g/cm3)=22.7ml.
K2MnO4+MnO2+O2↑,可选择的发生装置是A,因为过程中需要加热。实验室制取二氧化碳的化学方程式为CaCO3 + 2HCl=CaCl2 + H2O + CO2↑,可选择的收集装置是D,因为二氧化碳的密度大于空气。①实验室若要配制5%的双氧水150g,需要30%双氧水(密度1.1g/cm3)=5%×150g÷(30%×1.1g/cm3)=22.7ml.
解设:理论上最多可产生氧气质量为x。
2H2O2== 2H2O + O2↑
68 32
68×5% x
68:32=(68 g×5%) : x
x=1.6g

练习册系列答案
相关题目