题目内容
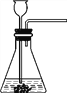
【题目】某化学学习小组用如图装置来探究“影响H2O2分解速率”的因素。
(1)写出实验室用二氧化锰催化双氧水分解的化学方程式________________。
【提出问题】影响双氧水分解速率的因素有哪些?
【猜想与假设】a.与双氧水浓度有关;b.与反应时温度有关。
【设计实验】
甲组同学有如下实验设计方案,见表(测量各生成一瓶相同体积O2所需要的时间)。
实验编号 | 温度 | 催化剂 | 浓度 | 时间 |
甲组实验Ⅰ | 25 ℃ | 1 g二氧化锰 | 10 mL 2%H2O2 | 115 s |
甲组实验Ⅱ | 25 ℃ | 1 g二氧化锰 | 10 mL 5%H2O2 | 35 s |
甲组实验Ⅲ | 35 ℃ | 1 g二氧化锰 | 10 mL 5%H2O2 | 15 s |
此实验中宜采用的气体收集方法是:________。
【收集证据】(2)要比较温度对双氧水分解快慢的影响,应选择的实验编号是________。
【得出结论】(3)根据上述实验得出的结论是________________________________________。
【继续探究】H2O2分解生成O2的快慢还与哪些因素有关?请你帮助他们继续探究。写出假设和实验方案。假设:________________________________________________;实验方案:___________________________________________。

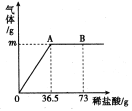
(4)乙组同学研究酸、碱对H2O2分解速率的影响的变化曲线如图,请你观察右图回答问题。
①写出一条规律性结论:________________________________________________________;
②乙组提出可以用BaO2固体与硫酸溶液反应制H2O2(已知还生成另一种物质),其化学反应方程式为________________________________;支持这一方案的理由是________________________________。
【答案】 2H2O2![]() 2H2O+O2↑ 排水法 Ⅱ、Ⅲ 温度越高或反应物浓度越大,反应速率越快 双氧水分解生成氧气的快慢还与催化剂的多少有关 取等浓度等体积的双氧水两份,其中一份加入1 g二氧化锰,另一份加入1.5 g二氧化锰,在相同的温度下,比较收集等体积氧气需要的时间长短 相同条件下,H2O2在碱性环境下放出气体速率较快 BaO2+H2SO4===BaSO4↓+H2O2 过氧化氢在酸性环境下分解较慢
2H2O+O2↑ 排水法 Ⅱ、Ⅲ 温度越高或反应物浓度越大,反应速率越快 双氧水分解生成氧气的快慢还与催化剂的多少有关 取等浓度等体积的双氧水两份,其中一份加入1 g二氧化锰,另一份加入1.5 g二氧化锰,在相同的温度下,比较收集等体积氧气需要的时间长短 相同条件下,H2O2在碱性环境下放出气体速率较快 BaO2+H2SO4===BaSO4↓+H2O2 过氧化氢在酸性环境下分解较慢
【解析】分析:(1)从实验室用二氧化锰催化双氧水分解制取和收集较纯净的氧气进行分析;
【收集证据】(2)和【得出结论】(3)从温度对双氧水分解快慢的影响进行分析;
【继续探究】从双氧水分解生成氧气的快慢还与催化剂的多少有关进行分析;
(4)①结合图形进行分析;②![]() 固体与硫酸反应的化学方程式进行分析;
固体与硫酸反应的化学方程式进行分析;
解答: (1) ![]() 在
在![]() 催化下分解前后其质量和性质都没有发生变化,
催化下分解前后其质量和性质都没有发生变化,![]() 在
在![]() 催化下分解生成水和氧气,反应的化学反应为:
催化下分解生成水和氧气,反应的化学反应为: ![]() ;解制取和收集较纯净的氧气,应采用排水集气法进行收集;
;解制取和收集较纯净的氧气,应采用排水集气法进行收集;
(2)要比较温度对双氧水分解快慢的影响,温度应该不同,所以选择的实验编号是Ⅱ、Ⅲ;
(3)假设双氧水分解生成氧气的快慢还与催化剂的多少有关,试验方案为:取等浓度等体积的双氧水两份,其中一份加入1 g二氧化锰,另一份加入1.5 g二氧化锰,在相同的温度下,比较收集等体积氧气需要的时间长短;
(4)①有图可知,相同条件下,H2O2在碱性环境下放出气体速率较快;
②过氧化氢在酸性环境下分解较慢,化学反应方程![]() 。
。
本题答案:(1). ![]() ,排水法 (2). Ⅱ、Ⅲ (3). 温度越高或反应物浓度越大,反应速率越快;双氧水分解生成氧气的快慢还与催化剂的多少有关 ;取等浓度等体积的双氧水两份,其中一份加入1 g二氧化锰,另一份加入1.5 g二氧化锰,在相同的温度下,比较收集等体积氧气需要的时间长短 (4). ①相同条件下,H2O2在碱性环境下放出气体速率较快; ②.
,排水法 (2). Ⅱ、Ⅲ (3). 温度越高或反应物浓度越大,反应速率越快;双氧水分解生成氧气的快慢还与催化剂的多少有关 ;取等浓度等体积的双氧水两份,其中一份加入1 g二氧化锰,另一份加入1.5 g二氧化锰,在相同的温度下,比较收集等体积氧气需要的时间长短 (4). ①相同条件下,H2O2在碱性环境下放出气体速率较快; ②. ![]() , 过氧化氢在酸性环境下分解较慢。
, 过氧化氢在酸性环境下分解较慢。