题目内容
阅读下列材料,完成下列探究:
珍珠约含92%的CaCO3、4%的蛋白质(氨基酸)以及水等其他物质。以珍珠磨成的珍珠粉具有安神、美容等医用价值。央视《每周质量报告》曾揭露现今市场上存在大量以蚌壳粉冒充的珍珠粉(用氢氧化钠溶液去除蚌壳表面的有机物,用双氧水去除表面的黑色素等,然后磨成粉即可)。某研究性学习小组对本地的一种市售珍珠粉进行了以下探究。
探究一:该珍珠粉的主要成分
(1)小名认为根据实验①、②可以推断样品中一定含有碳酸钙,小星不同意其观点。为了确认样品中含有碳酸钙,他需要补充完成的实验是(写出实验方法与现象): ;
(2)根据上述实验,可以判断该珍珠粉为 (填“真”或“假”)。
探究二:该珍珠粉中碳酸钙含量的测定
【方法1】小王用右图1所示装置测定该珍珠粉中碳酸钙的含量。实验方案如下:

(1)检查装置气密性:按图连接装好置后,将注射器活塞(不考虑活塞的摩擦和自重,下同)从刻度1mL处向上拉至刻度20mL处, (填操作和现象),则气密性良好。
(2)在锥形瓶内装入0.4g上述珍珠粉样品,注射器内吸入12mL的稀盐酸,再次连接装置。
(3)用力向锥形瓶内注入所有稀盐酸,并晃动锥形瓶。当没有气泡产生后,记录注射器刻度为92mL。
(4)数据处理:该实验过程中产生CO2的体积为 mL,再根据CO2的密度(约2g/L)计算出其质量,计算出碳酸钙的质量,从而计算该珍珠粉中碳酸钙的含量。
【方法2】同组的小明同学另外设计了一套装置,如右图2。实验方案如下:

(1)检查装置气密性;
(2)在右图Y形装置左管内装入1.1g上述珍珠粉样品,右管内倒入一定量的稀盐酸,针筒(规格为250mL)活塞推到底部,再次连接装置。
(3)设法使左右两管内的药品混合,反应结束后读取针筒读数为220mL。
(4)数据处理:请计算该珍珠粉中碳酸钙的质量分数。(写出计算过程,最终结果保留小数点后1位。4分)
【实验反思】
(1)考虑针筒的因素,上述两个实验方案对珍珠粉的用量多少必须作要求吗?为什么?
。
(2)【方法2】中第(3)步如何实现两种药品的混合? 。
(3)小明设计的装置与小王比,有何优点? (写出1点即可)。
珍珠约含92%的CaCO3、4%的蛋白质(氨基酸)以及水等其他物质。以珍珠磨成的珍珠粉具有安神、美容等医用价值。央视《每周质量报告》曾揭露现今市场上存在大量以蚌壳粉冒充的珍珠粉(用氢氧化钠溶液去除蚌壳表面的有机物,用双氧水去除表面的黑色素等,然后磨成粉即可)。某研究性学习小组对本地的一种市售珍珠粉进行了以下探究。
探究一:该珍珠粉的主要成分
| 序号 | 实验内容 | 实验现象 | 实验结论 |
| ① | 取少量样品于烧杯中,滴加稀盐酸 | 有大量气泡生成 | 本格不填 |
| ② | 用铂丝蘸取①中溶液,在酒精灯上灼烧 | 火焰为砖红色 | 溶液中含有钙离子 |
| ③ | 另取少量样品于烧杯中,加水充分溶解,滴加 | 无蓝色出现 | 样品中不含有淀粉 |
| ④ | 另取少量样品于烧杯中,加水溶解,静置、过滤,在滤液中加入适量浓硝酸,加热至沸 | __ | 样品中含蛋白粉 (氨基酸) |
(2)根据上述实验,可以判断该珍珠粉为 (填“真”或“假”)。
探究二:该珍珠粉中碳酸钙含量的测定
【方法1】小王用右图1所示装置测定该珍珠粉中碳酸钙的含量。实验方案如下:

(1)检查装置气密性:按图连接装好置后,将注射器活塞(不考虑活塞的摩擦和自重,下同)从刻度1mL处向上拉至刻度20mL处, (填操作和现象),则气密性良好。
(2)在锥形瓶内装入0.4g上述珍珠粉样品,注射器内吸入12mL的稀盐酸,再次连接装置。
(3)用力向锥形瓶内注入所有稀盐酸,并晃动锥形瓶。当没有气泡产生后,记录注射器刻度为92mL。
(4)数据处理:该实验过程中产生CO2的体积为 mL,再根据CO2的密度(约2g/L)计算出其质量,计算出碳酸钙的质量,从而计算该珍珠粉中碳酸钙的含量。
【方法2】同组的小明同学另外设计了一套装置,如右图2。实验方案如下:

(1)检查装置气密性;
(2)在右图Y形装置左管内装入1.1g上述珍珠粉样品,右管内倒入一定量的稀盐酸,针筒(规格为250mL)活塞推到底部,再次连接装置。
(3)设法使左右两管内的药品混合,反应结束后读取针筒读数为220mL。
(4)数据处理:请计算该珍珠粉中碳酸钙的质量分数。(写出计算过程,最终结果保留小数点后1位。4分)
【实验反思】
(1)考虑针筒的因素,上述两个实验方案对珍珠粉的用量多少必须作要求吗?为什么?
。
(2)【方法2】中第(3)步如何实现两种药品的混合? 。
(3)小明设计的装置与小王比,有何优点? (写出1点即可)。
探究一:③碘水或碘酒 ④产生黄色固体
(1)将①生成的气体通入盛有澄清石灰水的试管中,变浑浊则证明是含有碳酸钙。
(2)真
探究二:【方法1】(1)松开注射器活塞,活塞重新回到1刻度处 (4)80mL
【方法2】(4)生成二氧化碳的质量为0.44g(1分)
参加反应的碳酸钙质量为1g(2分)
碳酸钙的质量分数为90.9%(1分)
【实验反思】
(1)如果珍珠粉用量太大,生成的气体超过针筒的容量限制,无法测量生成二氧化碳的体积。
(2)将Y形装置向左倾斜,直至使稀盐酸流入左边管内与珍珠粉充分接触。
(3)不需要考虑加入的盐酸对测量气体体积的影响或酸与珍珠粉混合时不会出现冲塞现象或方法1加入盐酸时可能会了出现冲塞现象。(其他合理答案均可得分)
(1)将①生成的气体通入盛有澄清石灰水的试管中,变浑浊则证明是含有碳酸钙。
(2)真
探究二:【方法1】(1)松开注射器活塞,活塞重新回到1刻度处 (4)80mL
【方法2】(4)生成二氧化碳的质量为0.44g(1分)
参加反应的碳酸钙质量为1g(2分)
碳酸钙的质量分数为90.9%(1分)
【实验反思】
(1)如果珍珠粉用量太大,生成的气体超过针筒的容量限制,无法测量生成二氧化碳的体积。
(2)将Y形装置向左倾斜,直至使稀盐酸流入左边管内与珍珠粉充分接触。
(3)不需要考虑加入的盐酸对测量气体体积的影响或酸与珍珠粉混合时不会出现冲塞现象或方法1加入盐酸时可能会了出现冲塞现象。(其他合理答案均可得分)
试题分析:探究一:③根据实验现象“无蓝色出现”,实验结论“样品中不含有淀粉”,再结合淀粉的特性(碘遇淀粉变蓝),可知向溶液中滴加的是碘水或碘酒。
④由于氨基酸遇浓硝酸会发生硝化反应而变黄色,故根据实验结论“样品中含蛋白粉(氨基酸)”,可知向滤液中加入适量浓硝酸,加热至沸时,溶液中有黄色固体生成。
(1)因为有气泡产生不一定是二氧化碳,故不能确定碳酸盐,所以要将①生成的气体通入盛有澄清石灰水的试管中,若石灰水变浑浊,则可证明含有碳酸钙。
(2)根据上面的分析可知,由于样品中含蛋白粉(氨基酸),故知该珍珠粉为真珍珠粉。
探究二:【方法1】(1)若装置气密性良好,则当将注射器活塞拉上再松开的时候,在大气压的作用下,活塞会重新回到原来的位置。
(4)根据题意,该实验过程中产生CO2的体积=92ml-12ml=80ml。
【方法2】(4)根据注射器读数为220mL,则生成的二氧化碳的质量=0.22L×2g/L=0.44g。
设珍珠粉中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 0.44g
100:x =44:0.44g
解得,x=1g
则该珍珠粉中碳酸钙的质量分数
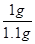 ×100%≈90.9%
×100%≈90.9%【实验反思】
(1)如果珍珠粉用量太大,生成的气体的量会超过针筒的容量限制,则无法测量生成二氧化碳的体积。
(2)将Y形装置向左倾斜,直至使稀盐酸流入左边管内与珍珠粉充分接触即可。
(3)小明设计的装置与小王比,不需要考虑加入的盐酸对测量气体体积的影响或酸与珍珠粉混合时不会出现冲塞现象或方法1加入盐酸时可能会了出现冲塞现象。
点评:对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。在研究物质组成时,通过定性的探究实验不能确定某组成成分时,可通过定量研究加以判断;定量研究时,质量守恒思想是进行推断的根本依据。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 。
。


 ;已知:同温同压下气体的体积比等于气体的分子数之比)。实验室模拟合成氨气的流程如下:
;已知:同温同压下气体的体积比等于气体的分子数之比)。实验室模拟合成氨气的流程如下: