题目内容
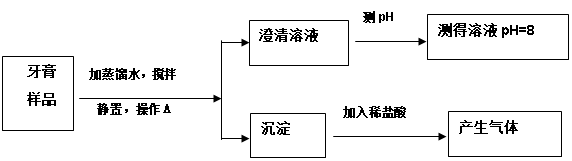
CO是一种无色、无味、有毒的可燃气体污染物,具有还原性,可用于冶金工业。某兴趣小组为探究其具有还原性,设计了下图所示的实验装置。请回答以下有关问题:

①CO气体能使人中毒,其原因是 ;
②实验开始时,先通入CO一段时间后,再加热,其原因是 ;
③实验中图B处发生的现象是 。
④该装置中有一个明显的缺陷,请指出改正方法 。

①CO气体能使人中毒,其原因是 ;
②实验开始时,先通入CO一段时间后,再加热,其原因是 ;
③实验中图B处发生的现象是 。
④该装置中有一个明显的缺陷,请指出改正方法 。
①一氧化碳极易与血液中的血红蛋白结合从而使血红蛋白不能极好地与氧气结合,造成人体内缺氧;
②排除装置中空气,防止加热时发生爆炸;
③澄清的石灰水变浑浊;
④在C处安装一个贮气囊或放置一个燃着的酒精灯。
②排除装置中空气,防止加热时发生爆炸;
③澄清的石灰水变浑浊;
④在C处安装一个贮气囊或放置一个燃着的酒精灯。
试题分析:①CO气体能使人中毒,其原因是一氧化碳与血红蛋白的结合能力比氧与血红蛋白的结合能力高200~300倍,所以一氧化碳极易与血红蛋白结合,形成碳氧血红蛋白,使血红蛋白丧失携氧的能力和作用,造成组织窒息;
②一氧化碳具有可燃性,若混有了氧气,在点燃的条件下可能会发生爆炸,所以点燃时应该先通入一氧化碳等排尽装置内的空气,才能防止在加热时发生爆炸;
③一氧化碳还原氧化铜在加热的条件下生成铜和二氧化碳,故图B处可以观察到澄清石灰水变浑浊的现象;
(4)一氧化碳有毒,直接排入空气中会污染空气,所以在C处少了一个尾气处理装置。
点评:本题主要对一氧化碳还原氧化铜的实验的相关知识进行了考查,该实验是中考的热点,学生应注意总结和加强训练。

练习册系列答案
相关题目