题目内容
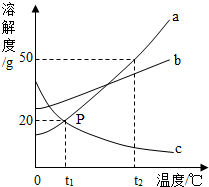
 请根据图中a、b、c三种物质的溶解度曲线,回答下列问题:
请根据图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)t2℃a、b、c三种物质的饱和溶液的质量分数的大小关系是________
(2)要使c从其浓溶液中结晶,应采取________的方法.
(3)t2℃时向100g水中加入55g固体a,开始发现全部溶解,一段时间后又有部分固体a析出,你认为开始全部溶解的原因可能是________
(4)将t2℃时的a、b、c三种物质的饱和溶液降温到t1℃时,溶液中溶质质量分数最小的是________(填写物质序号).
(5)分别装有a、c两种固体物质的饱和溶液两只试管,分别放入装有水的两个烧杯中,向两只烧杯中加入一定量的硝酸铵固体并搅拌均匀,一段时间后有固体析出的是________(选填“a”或“c”)
解:(1)根据溶解度曲线可知t2℃a、b、c三种物质的溶解度大小顺序是a>b>c;由饱和溶液中溶质的质量分数= ×100% 可知:溶解度越大质量分数也就越大,所以此时溶液的质量分数关系a>b>c;
×100% 可知:溶解度越大质量分数也就越大,所以此时溶液的质量分数关系a>b>c;
故答案为:a>b>c;
(2)c物质的溶解度随温度的升高而降低,可以采用加热升温的方法得到晶体;
故答案为:加热升温;
(3)t2℃时向100g水中加入55g固体a,发现全部溶解,可以判断该物质在溶解的时候可能是放出了热量,而a的溶解度随温度的升高而增大,而使a物质全部溶解,等温度降低后又析出晶体;
故答案为:
a物质溶于水放热;
(4)将t2℃时的a、b、c三种物质的饱和溶液降温到t1℃时,ab仍为饱和溶液,且b的溶解度>a的溶解度,而c由于溶解度增大而无晶体析出,所以其溶解的物质还是和先前的t2℃相同,也就是此时计算还是要考虑该温度下的溶解度,所以在t1℃,溶解物质的关系就是c<a<b.根据饱和时溶质的质量分数的计算式: ×100%,即溶解度越大质量分数也就越大,所以此时溶液的质量分数关系是a>b>c;
×100%,即溶解度越大质量分数也就越大,所以此时溶液的质量分数关系是a>b>c;
故答案为:a>b>c;
(5)硝酸铵溶于水使溶液的温度降低,a的溶解度随温度的降低而减小,c的溶解度随温度的降低而增大;所以向两只烧杯中加入一定量的硝酸铵固体并搅拌均匀,一段时间后有固体析出的是a;
故答案为:a
分析:(1)根据溶解度曲线可知三种物质的溶解度,并结合饱和溶液中溶质的质量分数= ×100%分析解答;
×100%分析解答;
(2)c物质的溶解度随温度的升高而降低,可以采用加热升温的方法得到晶体;
(3)根据溶解时溶液的放热和吸热现象来解答;
(4)根据物质的溶解度随温度的变化及饱和溶液中溶质的质量分数分析解答;
(5)硝酸铵溶于水使溶液的温度降低,a的溶解度随温度的降低而减小,c的溶解度随温度的降低而增大.
点评:本题考查了从溶解度曲线图上读取信息、分析及获取信息的能力.从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下,不同溶质的溶解度;温度对不同物质的溶解度影响不同等知识,并结合溶质的质量分数分析解答.
 ×100% 可知:溶解度越大质量分数也就越大,所以此时溶液的质量分数关系a>b>c;
×100% 可知:溶解度越大质量分数也就越大,所以此时溶液的质量分数关系a>b>c;故答案为:a>b>c;
(2)c物质的溶解度随温度的升高而降低,可以采用加热升温的方法得到晶体;
故答案为:加热升温;
(3)t2℃时向100g水中加入55g固体a,发现全部溶解,可以判断该物质在溶解的时候可能是放出了热量,而a的溶解度随温度的升高而增大,而使a物质全部溶解,等温度降低后又析出晶体;
故答案为:
a物质溶于水放热;
(4)将t2℃时的a、b、c三种物质的饱和溶液降温到t1℃时,ab仍为饱和溶液,且b的溶解度>a的溶解度,而c由于溶解度增大而无晶体析出,所以其溶解的物质还是和先前的t2℃相同,也就是此时计算还是要考虑该温度下的溶解度,所以在t1℃,溶解物质的关系就是c<a<b.根据饱和时溶质的质量分数的计算式:
 ×100%,即溶解度越大质量分数也就越大,所以此时溶液的质量分数关系是a>b>c;
×100%,即溶解度越大质量分数也就越大,所以此时溶液的质量分数关系是a>b>c;故答案为:a>b>c;
(5)硝酸铵溶于水使溶液的温度降低,a的溶解度随温度的降低而减小,c的溶解度随温度的降低而增大;所以向两只烧杯中加入一定量的硝酸铵固体并搅拌均匀,一段时间后有固体析出的是a;
故答案为:a
分析:(1)根据溶解度曲线可知三种物质的溶解度,并结合饱和溶液中溶质的质量分数=
 ×100%分析解答;
×100%分析解答;(2)c物质的溶解度随温度的升高而降低,可以采用加热升温的方法得到晶体;
(3)根据溶解时溶液的放热和吸热现象来解答;
(4)根据物质的溶解度随温度的变化及饱和溶液中溶质的质量分数分析解答;
(5)硝酸铵溶于水使溶液的温度降低,a的溶解度随温度的降低而减小,c的溶解度随温度的降低而增大.
点评:本题考查了从溶解度曲线图上读取信息、分析及获取信息的能力.从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下,不同溶质的溶解度;温度对不同物质的溶解度影响不同等知识,并结合溶质的质量分数分析解答.

练习册系列答案
相关题目
 请根据图中a、b、c三种物质的溶解度曲线,回答下列问题:
请根据图中a、b、c三种物质的溶解度曲线,回答下列问题: 请根据图中a、b、c三种物质的溶解度曲线,回答下列问题:
请根据图中a、b、c三种物质的溶解度曲线,回答下列问题: 请根据图中a、b、c三种物质的溶解度曲线,回答下列问题:
请根据图中a、b、c三种物质的溶解度曲线,回答下列问题: 请根据图中a、b、c三种物质的溶解度曲线,回答下列问题:
请根据图中a、b、c三种物质的溶解度曲线,回答下列问题: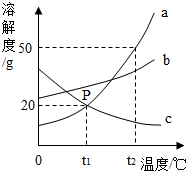 请根据图中a、b、c三种物质的溶解度曲线,回答下列问题:
请根据图中a、b、c三种物质的溶解度曲线,回答下列问题: